
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:阅读理解

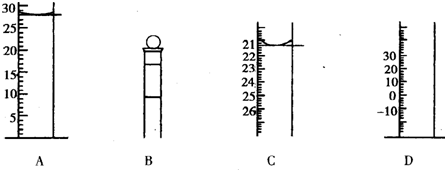
 ,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1.
,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1.| 实验编号 | NaOH溶液的体积(mL) |
| 1 | 22.52 |
| 2 | 22.49 |
| 3 | 22.50 |
| ||
(
|
| ||
(
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要80mL 2mol/L碳酸钠溶液。回答下列有关配制该溶液的问题(实验室中没有80mL规格的容量瓶):
(1)所需要的仪器为:托盘天平、量筒、烧杯、玻璃棒、_________、_________。
(2)配制该溶液需要Na2CO3的质量为_________g。(2分)
(3)配制溶液的操作顺序是(填序号)_________。(2分)
①转移溶液; ②轻摇使溶液混合均匀; ③洗涤并转移洗涤液; ④加盖倒转摇匀溶液;
⑤定容; ⑥称量; ⑦溶解; ⑧计算
(4)正式配制前必须进行的一项实验操作是__________________。
(5)试分析下列操作对所配溶液的浓度有何影响:(填写编号)A.偏高;B.不变;C.偏低。
①配制溶液时未洗涤烧杯并转移洗涤液_________;
②定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线_________;
③定容时俯视刻度线_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com