
【题目】甲醇被称为21世纪的新型燃料,工业上在一定条件下可利用反应I和II来制备:
(1)已知在25°C、101kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则表示燃烧热的热化学方程式为_______________________。
(2)将1.0 molCH4和2.0 molH2O(g)通入容积为10 L密闭容器中,CH4(g)+H2O(g)![]() CO(g)+3H2(g)(I),CH4的转化率与温度、压强的关系如图所示:
CO(g)+3H2(g)(I),CH4的转化率与温度、压强的关系如图所示:
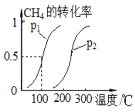
①该反应的△H______0,图中的p1 ____ p2(填“<”、“>”或“=”)
②已知100℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________________,该反应的平衡常数为_______(mol·L-1)2
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___________(填序号).
CH3OH(g) △H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___________(填序号).
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大 D.再充入amolCO和3amolH2.
(4)为提高燃烧效率,某燃料电池以甲醇原料,NaOH溶液为电解质,其负极电极反应式为______________
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H= -725.76 kJ·mol-1 > < 0.030 molL-1min-1 2.25×10-2 BD CH3OH-6e-+8OH-=CO32-+6H2O
O2(g)=CO2(g)+2H2O(l) △H= -725.76 kJ·mol-1 > < 0.030 molL-1min-1 2.25×10-2 BD CH3OH-6e-+8OH-=CO32-+6H2O
【解析】
(1)结合燃烧热的概念书写甲醇燃烧的热化学方程式;
(2)①根据CH4的平衡转化率与温度、压强的关系分析判断;
②根据v=![]() 计算反应速率,根据化学平衡常数的含义计算K;
计算反应速率,根据化学平衡常数的含义计算K;
(3)平衡正向移动,就可以提高甲醇的产率;
(4)在燃料电池中,通入燃料的电极为负极,负极失去电子发生氧化反应,通入O2或空气的电极为正极,正极得到电子发生还原反应,结合电解质溶液的酸碱性书写电极反应式。
(1)甲醇的相对分子质量是32,在25°C、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则32 g甲醇完全燃烧放出热量为Q=22.68 kJ×32=725.76 kJ,所以表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ·mol-1;
(2)①根据图象可知:在压强不变时,温度升高,CH4的平衡转化率增大,说明升高温度,化学平衡正向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故△H>0;该反应的正反应为气体体积增大的反应,在温度不变时,增大压强,化学平衡向气体体积减小的逆反应方向移动。根据图象可知,CH4的平衡转化率:p1>p2,说明压强:p1<p2;
②将1.0 molCH4和2.0 molH2O(g)通入容积为10 L密闭容器中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),在100℃时达到平衡所需的时间为5 min,甲烷转化率为0.5,则反应的CH4的浓度为△c(CH4)=
CO(g)+3H2(g),在100℃时达到平衡所需的时间为5 min,甲烷转化率为0.5,则反应的CH4的浓度为△c(CH4)=![]() =0.05 mol/L,△c(H2O)= △c(CO)=△c(CH4)=0.05 mol/L,则△c(H2)=3△c(CH4)=0.15 mol/L,所以v(H2)=
=0.05 mol/L,△c(H2O)= △c(CO)=△c(CH4)=0.05 mol/L,则△c(H2)=3△c(CH4)=0.15 mol/L,所以v(H2)=![]() =0.030 mol/(L·min);平衡时:c(CH4)=0.05 mol/L,c(H2O)=(2 mol÷10 L)- 0.05 mol/L=0.15 mol/L,c(CO)= 0.05 mol/L,c(H2)= 0.15 mol/L,所以该温度下该反应的化学平衡常数K=
=0.030 mol/(L·min);平衡时:c(CH4)=0.05 mol/L,c(H2O)=(2 mol÷10 L)- 0.05 mol/L=0.15 mol/L,c(CO)= 0.05 mol/L,c(H2)= 0.15 mol/L,所以该温度下该反应的化学平衡常数K=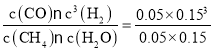 =2.25×10-2;
=2.25×10-2;
(3)根据方程式CO(g)+2H2(g)![]() CH3OH(g) △H<0可知:该反应的正反应为气体体积减小的放热反应。
CH3OH(g) △H<0可知:该反应的正反应为气体体积减小的放热反应。
A. 升高温度,化学平衡向吸热的逆反应方向移动,甲醇产率降低,A不符合题意; B. 将CH3OH(g)从体系中分离出来,即减小生成物浓度,平衡正向移动,甲醇产率增大,B符合题意;
C. 恒容下充入He,使体系的总压强增大,平衡混合物中各组分的浓度不变,化学平衡不移动,甲醇产率不变,C不符合题意;
D. 再充入amolCO和3amolH2,由于CO、H2反应的物质的量的比是1:2,所以相当于充入amolCO和2amolH2,反应达到平衡后又加入amolH2。充入amolCO和2amolH2,就是增大体积的压强,平衡正向移动,产生更多甲醇;反应达到平衡后又加入amolH2,增大H2的浓度,平衡正向移动,又产生甲醇,因此最终达到平衡时,甲醇产率增大,D符合题意;
故合理选项是BD;
(4)为提高燃烧效率,某燃料电池以甲醇原料,NaOH溶液为电解质,在燃料电池中,通入燃料的电极为负极,失去电子,发生氧化反应,由于电解质溶液为碱性,因此燃料甲醇反应产生的CO2


科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
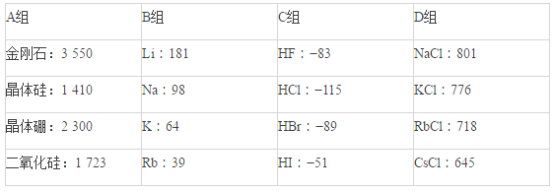
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.01mol·L-1一元酸HR溶液中逐渐通入氨气[常温下NH3·H2O电离平衡常数K=1.76×10-5],保持温度和溶液体积不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述不正确的是
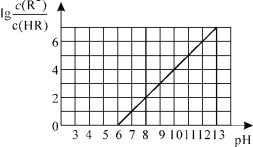
A.0.01mol·L-1HR溶液的pH约为4
B.随着氨气的通入,![]() 逐渐减小
逐渐减小
C.当溶液为碱性时,c(R-)>c(HR)
D.当通入0.01 mol NH3时,溶液中存在:c(R-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O]是一种重要的还原剂,在空气中比一般的 亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
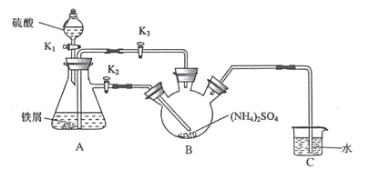
回答下列问题:
Ⅰ.制取莫尔盐
(1)连接装置,检査装置气密性。将 0.1mol(NH4)2SO4晶体置于玻璃仪器中 __填仪器 名称),将 6.0g 洁浄铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞 K3,打开 K2、K1,加完 55.0mL2mol·L-1 稀硫酸后关闭K1。
②待大部分铁粉溶解后,打开 K3、关闭 K2,此时可以看到的现象为__________;原因是____________。
③关闭活塞 K2、K3,采用 100℃水浴蒸发 B中水分,液面产生晶膜时,停止加热,冷却结晶、_______________、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的 pH 在 1~2 之间, 其目的为_______________。
④装置 C 的作用为 _____,装置 C 存在的缺点是_____。
Ⅱ.测定莫尔盐样品的纯度:取mg该样品配制成 1L 溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。
(1)已知:Cr2O72-还原产物为Cr3+,写出此反应的离子方程式_____。
(2)滴定时必须选用的仪器是_____。
①![]() ②
②![]() ③
③![]() ④
④ ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]()
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。[(NH4)2Fe(SO4)26H2O,Mr=392,BaSO4,Mr=233]
待测液→足量的 BaCl2 溶液→过滤→洗涤→干燥→称量→wg 固体
(3)莫尔盐晶体纯度为_____(用含 m、w 的式子表示,不用算出结果)。
(4)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式:H2O![]() H++OH-。下列叙述中,正确的是
H++OH-。下列叙述中,正确的是
A.向水中通入少量氯化氢气体,c(H+)增大,KW不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.升高温度,KW增大,pH不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
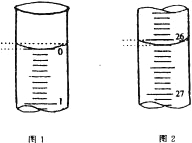
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为_________mL,终点读数为_____________mL;所用盐酸溶液的体积为______________ mL。
(4)某学生根据三次实验分别记录有关数据如下表:
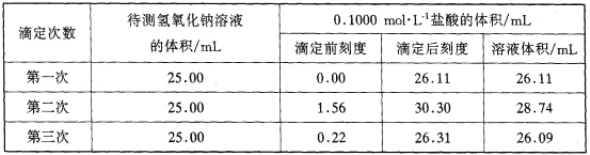
请用上述数据列式计算该氢氧化钠溶液的物质的量浓度 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
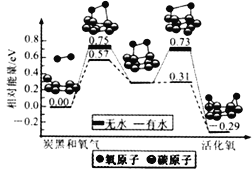
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com