
【题目】常温下,向1L0.01mol·L-1一元酸HR溶液中逐渐通入氨气[常温下NH3·H2O电离平衡常数K=1.76×10-5],保持温度和溶液体积不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述不正确的是
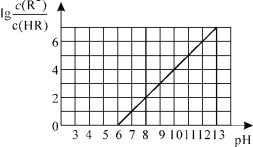
A.0.01mol·L-1HR溶液的pH约为4
B.随着氨气的通入,![]() 逐渐减小
逐渐减小
C.当溶液为碱性时,c(R-)>c(HR)
D.当通入0.01 mol NH3时,溶液中存在:c(R-)>c(NH4+)>c(H+)>c(OH-)
【答案】D
【解析】
A. pH=6时c(H+)=10-6,由图可得此时![]() =0,则Ka=
=0,则Ka=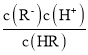 =10-6,设HR 0.01mol·L-1电离了X mol·L-1,Ka=
=10-6,设HR 0.01mol·L-1电离了X mol·L-1,Ka=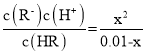 =10-6 ,解得X=10-6,pH=4,A项正确;
=10-6 ,解得X=10-6,pH=4,A项正确;
B. 由已知HR溶液中存在着HR分子,所以HR为弱酸,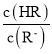 =
= = c(H+)/Ka温度不变时Ka的值不变,c(H+)浓度在减小,故
= c(H+)/Ka温度不变时Ka的值不变,c(H+)浓度在减小,故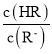 在减小,B项正确;
在减小,B项正确;
C.当溶液为碱性时,R-的水解会被抑制,c(R-)>c(HR),C项正确;
D. Ka=10-6,当通入0.01 mol NH3时,恰好反应生成NH4R,又因为常温下NH3·H2O电离平衡常数K=1.76×10-5,所以NH4R溶液中R-水解程度大于NH4+水解程度,NH4R溶液呈碱性,则c(NH4+)>c(R-)>c(OH-)>c(H+),D项错误;
答案选D。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32(aq)+CaSO4(s)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
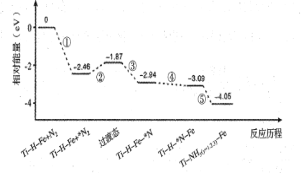
A.①为N![]() N的断裂过程
N的断裂过程
B.① ③在高温区发生,②④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
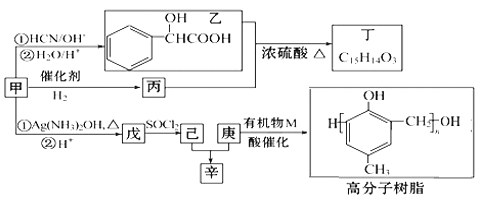
【题目】含氧有机物甲可用来制取多种有用的化工产品,合成路线如图:
已知:Ⅰ.RCHO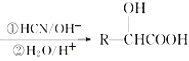
Ⅱ.RCOOH![]() RCOCl
RCOCl![]() RCOOR’(R、R’代表烃基)
RCOOR’(R、R’代表烃基)
(1)甲的含氧官能团的名称是___。写出检验该官能团常用的一种化学试剂的名称___。
(2)写出己和丁的结构简式:己__,丁__。
(3)乙有多种同分异构体,属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有___种。
(4)在NaOH溶液中发生水解反应时,丁与辛消耗NaOH的物质的量之比为__。
(5)庚与M合成高分子树脂的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
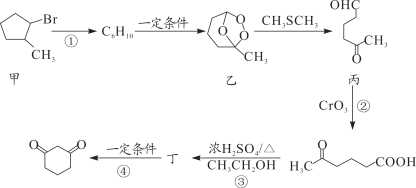
回答下列问题:
(1)甲的分子式为 __________。
(2)丙中含有官能团的名称是__________。
(3)反应①的反应类型是________;反应②的反应类型是_______。
(4)反应④的化学方程式_______。
(5)符合下列条件的乙的同分异构体共有______种。
①能发生银镜反应
②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。
写出其中在核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式:________。(任意一种)
(6)设计以![]() (丙酮)、乙醇、乙酸为原料制备
(丙酮)、乙醇、乙酸为原料制备![]() (2,4—戊二醇)的合成路线(无机试剂任选)_______。
(2,4—戊二醇)的合成路线(无机试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示:以相同的滴速分别向同体积的蒸馏水和0.1 mol/L CuSO4溶液中滴入NaCl溶液,氯离子浓度随氯化钠加入量的变化关系。图2表示:CuCl2溶液中氯离子浓度随温度变化关系。结合信息,下列推断不合理的是
已知:CuSO4溶液中存在平衡X:Cu2++4H2O![]() [Cu(H2O)4]2+(蓝色)
[Cu(H2O)4]2+(蓝色)
CuCl2溶液呈绿色,溶液中存在平衡Y:4Cl-+[Cu(H2O)4]2+![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
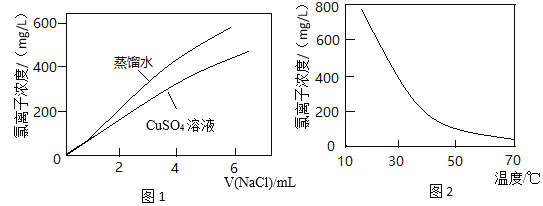
A.平衡Y是图1中两条曲线没有重合的主要原因
B.由图2可知平衡Y为吸热反应
C.平衡X是无水硫酸铜粉末和硫酸铜溶液颜色不同的原因
D.CuCl2溶液加水稀释,溶液最终变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上在一定条件下可利用反应I和II来制备:
(1)已知在25°C、101kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则表示燃烧热的热化学方程式为_______________________。
(2)将1.0 molCH4和2.0 molH2O(g)通入容积为10 L密闭容器中,CH4(g)+H2O(g)![]() CO(g)+3H2(g)(I),CH4的转化率与温度、压强的关系如图所示:
CO(g)+3H2(g)(I),CH4的转化率与温度、压强的关系如图所示:
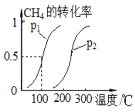
①该反应的△H______0,图中的p1 ____ p2(填“<”、“>”或“=”)
②已知100℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________________,该反应的平衡常数为_______(mol·L-1)2
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___________(填序号).
CH3OH(g) △H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___________(填序号).
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大 D.再充入amolCO和3amolH2.
(4)为提高燃烧效率,某燃料电池以甲醇原料,NaOH溶液为电解质,其负极电极反应式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SiHCl3(g)= SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
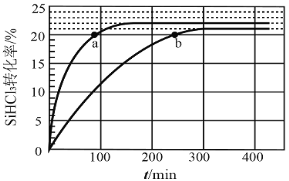
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是__________,要缩短反应达到平衡的时间,可采取的措施有_____________。
③比较a、b处反应速率大小:υa______υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =________(保留1位小数)。
=________(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com