
沈阳理工大学在废旧电池回收处理现状研究报告中报道了一种湿法处理方法,以下是对废旧电池材料(含有Ni(OH)2、碳粉、氧化铁和铝箔等)进行资源回收所设计的实验流程

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③金属离子在该实验流程下完全沉淀的pH:
离子 | Al3+ | Fe3+ | Ni2+ |
pH | 5.2 | 4.1 | 9.7 |
回答下列问题:
(1)物质A 的作用是调节溶液的pH以除去杂质Fe3+和Al3+,以下最适合作为A物质的是________。
A.NiO B.盐酸 C.NaOH D.氨水
(2)滤渣②的主要成分是_________________________________。
(3)写出加入Na2C2O4 溶液反应的化学方程式: _____________。
(4)写出电解滤液③的阴极反应式___________________________。
检验电解滤液③时阳极产生的气体的方法是用湿润的________试纸检验。
(5)由沉淀A生成Ni(OH)3的过程是先在滤渣③中加入过量NaOH溶液进行沉淀转化,待反应完全后再通入电解滤液③产生的气体进行氧化,请写出该氧化过程的离子方程式:__________________。
(6)如何检验Ni(OH)3是否洗涤干净?
________________________________。
(1)A
(2)Fe(OH)3 Al(OH)3
(3)NiCl2+Na2C2O4+2H2O===NiC2O4·2H2O +2NaCl
(4)2H++2e-=== H2↑ 淀粉碘化钾
(5)2Ni(OH)2 +2OH -+ Cl2===2Ni(OH)3+2Cl-
(6)用试管取少量最后一次洗涤液,滴加硝酸银溶液,若没有白色沉淀生成,则说明Ni(OH)3已经洗涤干净,若有白色沉淀生成,则说明Ni(OH)3没有洗涤干净。
【解析】滤液①中的溶质是NiCl2、HCl、AlCl3、FeCl3 ,用NiO调节溶液的pH既可以除去杂质Fe3+和Al3+,杂质Fe3+和Al3+分别转化为Fe(OH)3和Al(OH)3,又不引入其他杂质离子。则滤液②溶质主要是NiCl2,加入Na2C2O4后生成溶解度最小的NiC2O4·2H2O,故滤液③中主要含有NaCl,滤渣③中主要含有 NiC2O4·2H2O,NiC2O4·2H2O与NaOH溶液反应转化为Ni(OH)2 ,Ni(OH)2被电解滤液③时阳极产生的Cl2氧化为Ni(OH)3。


科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列说法或表述正确的是
A由水电离产生的c(H+)=1×10-2mol?L-1溶液中,可能存在:CO32-、NH4+、Cl- 、Na+
B某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
C Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为:3Ba2++6OH- +2Al3+ +3SO42-=3BaSO4↓+2Al(OH)3↓
D物质的量浓度均为1 mol?L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA (NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示
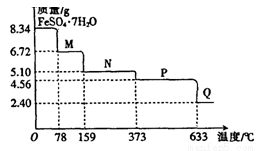
A.温度为78℃时固体物质M的化学式为FeSO4?5H2O
B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4 FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子 层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由大到小的顺序为:Z>Y> W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、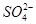
B.加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、
C.水电离产生的c(H+)=10-13mol·L-1的溶液中:Na+、Cl-、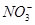 、
、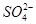
D.0.1 mol·L-1HNO3溶液中:Mg2+、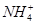 、Fe2+、Cl-
、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:填空题
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为 。
(2)N、P、As原子的第一电离能由大到小的顺序为 。
(3)NH3的沸点比PH3 高,原因是 ;PO43-离子的立体构型为 。
高,原因是 ;PO43-离子的立体构型为 。
(4)PH3分子中P原子采用 杂化。
(5)H3AsO4和H3A sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6) CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
常温下,浓度均为0.1 m ol/L 的下列四种盐溶液,其pH测定如下表所示:
ol/L 的下列四种盐溶液,其pH测定如下表所示:
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:选择题
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑
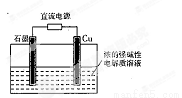
下列说法不正确的是
A.石墨电极上产生氢气
B.铜电极发生的电极反应为:2Cu -2e-+2OH-= Cu2O+H2O
C.铜电极接直流电源的正极
D.当有0.1 mol电子转移时,有0.1 molCu2O生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
某溶液只可能含有以下离子中的若干种:H+、NH4+ 、K+、Mg2+、NO2-、CO32-、NO3- ,现取两份200 mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2===H2O+NO2↑+NO↑)①第一份加足量AgNO3溶液后,有11.68 g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2 g;②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0 g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100 mL 0.5 mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。根据上述实验,以下推测不正确的是
A.原溶液一定不存在较大浓度的H+、Mg2+
B.原溶液确定含NH4+ 、NO2-、CO32-,且物质的量之比为5:2:1
C.不能确定原溶液是否含有K+、NO3-
D.实验中产生的棕色气体遇空气颜色会加深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com