
ЁОЬтФПЁПЖўМзУбБЛГЦЮЊ21ЪРМЭЕФаТаЭШМСЯЃЌвВПЩЬцДњЗњРћАКзїжЦРфМСЕШЃЌЖдГєбѕВуЮоЦЦЛЕзїгУЁЃЙЄвЕЩЯГЃВЩгУМзДМЦјЯрЭбЫЎЗЈРДЛёШЁЁЃЦфЗДгІЗНГЬЪНЮЊЃК2CH3OH(g)![]() CH3OCH3(g)ЃЋH2O(g)
CH3OCH3(g)ЃЋH2O(g)
ЭъГЩЯТСаЬюПеЃК
28ЁЂгаЛњЮяЗжзгжаЖМКЌЬМдЊЫиЃЌаДГіЬМдзгзюЭтВуЕчзгЕФЙьЕРБэЪОЪН_______________ЃЛ
аДГіМзДМЗжзгжаЙйФмЭХЕФЕчзгЪН_________________ЁЃ
29ЁЂЬМгыЭЌжїзхЕФЖЬжмЦкдЊЫиЯрБШЃЌЗЧН№ЪєадНЯЧПЕФЪЧ_________ЃЈЬюдЊЫиЗћКХЃЉЁЃаДГівЛИіФмжЄУїФуЕФНсТлЕФЛЏбЇЗНГЬЪН_____________________________________ЁЃ
30ЁЂдкЮТЖШКЭЬхЛ§ВЛБфЕФЧщПіЯТЃЌФмЫЕУїЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ______ЃЈбЁЬюБрКХЃЉ
a.CH3OHЕФЯћКФЫйТЪгыCH3OCH3ЕФЯћКФЫйТЪжЎБШЮЊ2ЃК1
b.ШнЦїФкбЙЧПБЃГжВЛБф
c.H2O(gЃЉХЈЖШБЃГжВЛБф
d.ЦјЬхЦНОљЯрЖдЗжзгжЪСПБЃГжВЛБф
31ЁЂвЛЖЈЮТЖШЯТЃЌдкШ§ИіЬхЛ§дМЮЊ2.0 LЕФКуШнУмБеШнЦїжаЗЂЩњЩЯЪіЗДгІЃК
ШнЦї | ЮТЖШЃЈЁцЃЉ | Ц№ЪМЮяжЪЕФСПЃЈmolЃЉ | ЦНКтЮяжЪЕФСПЃЈmolЃЉ | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ђђ | 387 | 0.80 | a | |
Ђѓ | 207 | 0.40 | 0.18 | 0.18 |
ЃЈ1ЃЉШєвЊЬсИпCH3OHЕФЦНКтзЊЛЏТЪЃЌПЩвдВЩШЁЕФДыЪЉЪЧ______ЃЈбЁЬюБрКХЃЉЁЃ
a.МАЪБвЦзпВњЮя b.Щ§ИпЮТЖШ c.ГфШыCH3OH d.НЕЕЭЮТЖШ
ЃЈ2ЃЉIКХШнЦїФкЕФЗДгІОЙ§t minДяЕНЦНКтЃЌдђCH3OHЕФЦНОљЗДгІЫйТЪЮЊ_____________ЃЈгУКЌtЕФЪНзгБэЪОЃЉЁЃIIКХШнЦїжаa =___________molЁЃ
32ЁЂШєЦ№ЪМЪБЯђШнЦїIжаГфШыCH3OH 0.2molЁЂCH3OCH3 0.30molКЭH2O 0.20molЃЌдђЗДгІНЋЯђ__________ЃЈЬюЁАе§ЁБЁАФцЁБЃЉЗДгІЗНЯђНјааЁЃ
ЁОД№АИЁП![]()
![]() C Na2SiO3+ CO2+ H2O=Na2CO3+H2SiO3Ё§ ac ad
C Na2SiO3+ CO2+ H2O=Na2CO3+H2SiO3Ё§ ac ad ![]() mol/(L.min) 0.32 е§
mol/(L.min) 0.32 е§
ЁОНтЮіЁП
28ЃЎЬМдзгКЫЕчКЩЪ§ЮЊ6ЃЌзюЭтВуга4ИіЕчзгЃЌЙьЕРБэЪОЪНЮЊ![]() ЃЛДМєЧЛљжаЧтбѕдзгМфаЮГЩвЛЬѕЙВМлМќЃЌЕчзгЪНЮЊ
ЃЛДМєЧЛљжаЧтбѕдзгМфаЮГЩвЛЬѕЙВМлМќЃЌЕчзгЪНЮЊ![]() ЃЛ
ЃЛ
29ЃЎЭЌжїзхгЩЩЯЖјЯТЗЧН№ЪєадМѕШѕЃЌЙЪЗЧН№ЪєадНЯЧПЕФЪЧCЃЛРћгУNa2SiO3+ CO2+H2O=Na2CO3+H2SiO3Ё§ЗДгІЃЌПЩжЄУїЬМЫсЕФЫсадБШЙшЫсЧПЃЌПЩвджЄУїCЕФЗЧН№ЪєадБШSiЧПЃЛ
30ЃЎ2CH3OHЃЈgЃЉЈTCH3OCH3ЃЈgЃЉ+H2OЃЈgЃЉЃЌЗДгІЪЧЦјЬхЬхЛ§ВЛБфЕФЗДгІЃЌДяЕНЦНКтЕФБъжОЪЧе§ФцЗДгІЫйТЪЯрЭЌЃЌИїзщЗжКЌСПБЃГжВЛБфЃЛ
aЃЎЫйТЪжЎБШЕШгкЛЏбЇЗНГЬМЦСПЪ§жЎБШЮЊе§ЗДгІЫйТЪжЎБШЃЌCH3OHЕФЯћКФЫйТЪгыCH3OCH3ЕФЯћКФЫйТЪжЎБШЮЊ2ЃК1ЃЌЫЕУїCH3OCH3ЕФе§ФцЗДгІЫйТЪЯрЭЌЃЌЙЪaе§ШЗЃЛ
bЃЎЗДгІЧАКѓЦјЬхЬхЛ§ВЛБфЃЌЗДгІЙ§ГЬжаШнЦїФкбЙЧПЪМжеБЃГжВЛБфЃЌВЛФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪbДэЮѓЃЛ
cЃЎH2OЃЈgЃЉХЈЖШБЃГжВЛБфЪЧЦЦЛЕЕФБъжОЃЌЙЪcе§ШЗЃЛ
dЃЎЗДгІЧАКѓЦјЬхжЪСПВЛБфЃЌЮяжЪЕФСПВЛБфЃЌЦјЬхЦНОљЯрЖдЗжзгжЪСПЪМжеБЃГжВЛБфЃЌВЛФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪdДэЮѓЃЛ
ЙЪД№АИЮЊЃКacЃЛ
31ЃЎЃЈ1ЃЉЂёЁЂЂѓЪЕбщПЩжЊЦ№ЪМСПЯрЭЌЃЌДяЕНЦНКтзДЬЌЃЌЮТЖШдНИпМзУбЮяжЪЕФСПМѕаЁЃЌЦНКтФцЯђНјааЃЌЫЕУїе§ЗДгІЮЊЗХШШЗДгІЃЌШєвЊЬсИпCH3OHЕФЦНКтзЊЛЏТЪЃЌашвЊИФБфЬѕМўЪЙЦНКте§ЯђНјааЃЌ
aЃЎМАЪБвЦзпВњЮяЃЌЦНКте§ЯђНјааЃЌМзДМзЊЛЏТЪдіДѓЃЌЙЪaе§ШЗЃЛ
bЃЎЗДгІЪЧЗХШШЗДгІЃЌЩ§ИпЮТЖШЦНКтФцЯђНјааЃЌЙЪbДэЮѓЃЛ
cЃЎГфШыCH3OHЃЌЯрЕБгкдіДѓбЙЧПЃЌЦНКтВЛЖЏЃЎЙЪcДэЮѓЃЛ
dЁЂНЕЕЭЮТЖШЦНКте§ЯђНјааЃЌМзДМзЊЛЏТЪдіДѓЃЌЙЪdе§ШЗЃЛ
ЙЪД№АИЮЊЃКadЃЛ
ЃЈ2ЃЉШєЦ№ЪМЪБЯђШнЦїIжаГфШыCH3OH 0.2molЁЂCH3OCH3 0.30molКЭH2O 0.30molЃЌПЩгыдЦНКтаЮГЩЕШаЇЦНКтЃЌдйдкЦНКтзДЬЌЕФЛљДЁЩЯМѕЩй0.1mol H2OЃЌКмУїЯдЦНКтЯђе§ЗНЯђвЦЖЏЁЃ
IКХШнЦїФкЕФЗДгІОЙ§tminДяЕНЦНКтЩњГЩCH3OCH3ЃЈgЃЉЮяжЪЕФСПЮЊ0.16molЃЌМЦЫуЯћКФМзДМЮяжЪЕФСПЮЊ0.32molЃЌНсКЯЗДгІЫйТЪИХФюМЦЫуМзДМБэЪОЕФЗДгІЫйТЪV=![]() =
=![]() mol/(L.min)ЃЛ
mol/(L.min)ЃЛ
вРОнШ§ЖЮЪНСаЪНМЦЫуЂёЕФЦНКтГЃЪ§ЃЌ
2CH3OHЃЈgЃЉЈTCH3OCH3ЃЈgЃЉ+H2OЃЈgЃЉ
Ц№ЪМСПЃЈmol/LЃЉ 0.2 0 0
БфЛЏСПЃЈmol/LЃЉ 0.16 0.08 0.08
ЦНКтСПЃЈmol/LЃЉ 0.04 0.08 0.08
ЦНКтГЃЪ§K=![]() =4ЃЛ
=4ЃЛ
ЂђЪЕбщЮТЖШВЛБфЦНКтГЃЪ§ВЛБфЃЌвРОнЦНКтГЃЪ§СаЪНМЦЫуaжЕ
2CH3OHЃЈgЃЉЈTCH3OCH3ЃЈgЃЉ+H2span>OЃЈgЃЉ
Ц№ЪМСПЃЈmol/LЃЉ 0.4 0 0
БфЛЏСПЃЈmol/LЃЉ a 0.5a 0.5a
ЦНКтСПЃЈmol/LЃЉ 0.4-a 0.5a 0.5a![]() =4ЃЌa=0.32molЃЛ
=4ЃЌa=0.32molЃЛ
32ЃЎШєЦ№ЪМЪБЯђШнЦїIжаГфШыCH3OH0.2molЁЂCH3OCH30.30molКЭH2OЮЊ0.20molЃЌМЦЫуДЫЪБХЈЖШЩЬQ=![]() =1.5ЃМKЃЌЦНКтГЃЪ§БШНЯЗжЮіХаЖЯЗДгІНјааЗНЯђЪЧе§ЯђНјааЃЛЙЪД№АИЮЊЃКе§ЁЃ
=1.5ЃМKЃЌЦНКтГЃЪ§БШНЯЗжЮіХаЖЯЗДгІНјааЗНЯђЪЧе§ЯђНјааЃЛЙЪД№АИЮЊЃКе§ЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЫЎШмвКжаЕФРызгЦНКтЪЧжабЇЛЏбЇжаживЊжЊЪЖЁЃ
ЂйГЃЮТЯТЃЌ0.001mol/LNaOHШмвКЕФpH=____ЃЛ
Ђк(NH4)2SO4ЪЧвЛжжживЊЕФЕЊЗЪЃЌГЄЦкЪЉгУЛсЪЙЭСШРЫсЛЏЃЌЦфдвђЪЧ_______ЃЈгУРызгЗНГЬЪНБэЪОЃЉЃЛ
ЂлвбжЊдк25ЁцЃКAgCl(s) ![]() AgЃЋ(aq)ЃЋClЃ(aq) Ksp=1.8ЁС10Ѓ10ЃЌAg2S(s)
AgЃЋ(aq)ЃЋClЃ(aq) Ksp=1.8ЁС10Ѓ10ЃЌAg2S(s) ![]() 2AgЃЋ(aq)ЃЋS2Ѓ(aq) Ksp=6.3ЁС10Ѓ50ЃЌЯђKClКЭK2SХЈЖШОљЮЊ0.001mol/LЕФЛьКЯШмвКжаЃЌж№ЕЮМгШыAgNO3ШмвКЃЌзюЯШВњЩњЕФГСЕэЪЧ_____ЃЈЬюЁАAgClЁБЛђЁАAg2SЁБЃЉЁЃ
2AgЃЋ(aq)ЃЋS2Ѓ(aq) Ksp=6.3ЁС10Ѓ50ЃЌЯђKClКЭK2SХЈЖШОљЮЊ0.001mol/LЕФЛьКЯШмвКжаЃЌж№ЕЮМгШыAgNO3ШмвКЃЌзюЯШВњЩњЕФГСЕэЪЧ_____ЃЈЬюЁАAgClЁБЛђЁАAg2SЁБЃЉЁЃ
ЃЈ2ЃЉМзДМЪЧПЩдйЩњФмдДЃЌЦфШМЩеШШЮЊ726.5kJЁЄmolЃ1ЁЃЯТСаФме§ШЗБэЪОМзДМШМЩеЕФШШЛЏбЇЗНГЬЪНЕФЪЧ____ЃЈЬюзжФИДњКХЃЉЁЃ
A.CH3OH(l)ЃЋ![]() O2(g)=CO2(g)ЃЋ2H2O(l) ЁїH=ЃЋ726.5kJЁЄmolЃ1
O2(g)=CO2(g)ЃЋ2H2O(l) ЁїH=ЃЋ726.5kJЁЄmolЃ1
B.CH3OH(l)ЃЋ![]() O2(g)=CO2(g)ЃЋ2H2O(l) ЁїH=726.5kJЁЄmolЃ1
O2(g)=CO2(g)ЃЋ2H2O(l) ЁїH=726.5kJЁЄmolЃ1
C.CH3OHЃЋ![]() O2=CO2ЃЋ2H2O ЁїH=726.5kJЁЄmolЃ1
O2=CO2ЃЋ2H2O ЁїH=726.5kJЁЄmolЃ1
ЃЈ3ЃЉ800Ёц,ЯђФГКуШнУмБеШнЦїжаГфШыЗДгІЮяAЃЌЗЂЩњЗДгІ2A(g) ![]() 2B(g)ЃЋC(g) ЁїH<0ЁЃвбжЊAЕФХЈЖШЫцЪБМфЕФБфЛЏШчЯТЃК
2B(g)ЃЋC(g) ЁїH<0ЁЃвбжЊAЕФХЈЖШЫцЪБМфЕФБфЛЏШчЯТЃК
ЗДгІЪБМф(ЃЈminЃЉ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
cЃЈAЃЉ(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
ЧыЛиД№ЯТСаЮЪЬтЃК
Ђйдк10-20minФкЃЌAЕФЦНОљЗДгІЫйТЪЮЊ________mol/(L.min)ЃЛ
ЂкВЛФмЫЕУїИУЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ__________ЃЈЬюзжФИДњКХЃЉЃЛ
A.ШнЦїФкЦјЬхУмЖШВЛдйБфЛЏ B.ШнЦїФкЦјЬхЦНОљФІЖћжЪСПВЛдйБфЛЏ C.ШнЦїФкЦјЬхЕФбЙЧПВЛдйБфЛЏ
Ђл800ЁцЪБЃЌЦНКтГЃЪ§K=_________ЃЛ
ЂмШєЮТЖШНЋЮЊ600ЁцЃЌЦфЦНКтГЃЪ§KНЋ________ЃЈЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЁЂЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ4ЃЉШчЭМЫљЪОЃЌБеКЯSКѓВЛОУЃЌПЩЙлВьЕНТЫжНaЖЫИННќГЪРЖЩЋЃЌдђЃК
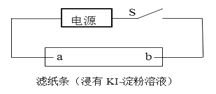
ЂйТЫжНbЖЫгыЕчдД__________ЃЈЬюЁАе§МЋЁБЛђЁАИК МЋЁБЃЉЯрСЌЃЛ
ЂкТЫжНaЖЫЗЂЩњЕФЕчМЋЗДгІЪНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПVCBЪЧяЎРызгЕчГиЕФвЛ-жжЬэМгМС,вдЛЗбѕввЭщ(EO)ЮЊдСЯжЦБИVCBЕФвЛжжКЯГЩТЗЯпШчЯТ:
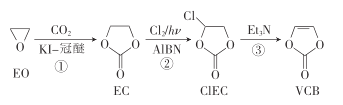
ЯТСаЫЕЗЈДэЮѓЕФЪЧ
A.ЗДгІЂйЕФдзгРћгУТЪЮЊ100%
B.ЂкЕФЗДгІРраЭЮЊШЁДњЗДгІ.
C.EOЁЂECЕФвЛТШДњЮяжжЪ§ЯрЭЌ
D.CIECЁЂVCBЗжзгжаЫљгадзгОљДІгкЭЌвЛЦНУц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСзПѓЪЏЕФжївЊГЩЗжЪЧCa5F(PO4)3ЃЌВЂКЌгаЩйСПMgOЁЂFe2O3ЕШдгжЪЁЃЙЄвЕЩЯвдСзПѓЪЏЮЊдСЯжЦБИH3PO4ЃЌвЛжжЩњВњСїГЬШчЯТЃК

вбжЊЃКCa5F(PO4)3 + 7H3PO4Ёњ5Ca(H2PO4)2 + HF
38ЁЂаДГігаЙиВйзїЕФУћГЦЃКЂё___________ЁЂЂѓ_________ЁЃЙЄвеСїГЬжаЩшМЦВйзїЂђгыЂѓЕФФПЕФЪЧ__________________________________ЁЃ
39ЁЂШєдкЪЕбщЪвРяВЩгУДЫжжЗНЗЈШмНтСзПѓЪЏЃЌЧыаДГіБиаыЕФЪЕбщзЂвтЪТЯюЃЌВЂЫЕУїРэгЩЃК_____________ЁЃ
40ЁЂСзПѓЪЏвВПЩжБНггУСђЫсШмНтЃЌСНжжЙЄвеЯрБШЃЌИУЙЄвеЕФгХЕуЪЧ____________________ЁЃ
41ЁЂВтЖЈВњЦЗСзЫсЕФХЈЖШПЩВЩгУЕЮЖЈЗЈЁЃзМШЗСПШЁ10.00 mLСзЫсВњЦЗЃЈУмЖШЮЊ1.526g/cm3ЃЉШмгкЫЎХфГЩ1LШмвКЃЛШЁЯЁЪЭКѓЕФШмвК20.00mLЃЌвдМзЛљГШЮЊжИЪОМСЃЌгУ0.103 mol/LБъзМNaOHШмвКЕЮЖЈЃЛЕБЙлВьЕНШмвКЧЁКУБфЩЋЃЌЧвдкАыЗжжгФкВЛБфЩЋЃЌМДЮЊЕЮЖЈжеЕуЃЈЩњГЩNaH2PO4ЃЉЃЌЯћКФБъзМШмвК20.16 mLЁЃ
ИУЪЕбщЙ§ГЬжаашвЊЕФЖЈСПвЧЦїга______________________________ЃЈаДУћГЦЃЉЁЃ
42ЁЂШєРэТлЩЯЕЮЖЈгІКФгУБъзМШмвК20.20 mLЃЌдђЯрЖдЮѓВюЮЊ______________ЃЈАДНќЫЦМЦЫуЗЈдђЃЉЁЃИУВњЦЗжаСзЫсЕФжЪСПЗжЪ§ЮЊ_____________ЃЈБЃСє3ЮЛаЁЪ§ЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌдЫгУЕчРыРэТлзіГіЕФдЄВте§ШЗЕФЪЧ
A.ВтЖЈФГЖўдЊШѕЫсФЦбЮШмвКЕФpHЃЌПЩФмаЁгк7
B.ЯЁЪЭ0.1mol/LCH3COOH(aq)ЃЌ![]() ПЩФмБфДѓвВПЩФмБфаЁ
ПЩФмБфДѓвВПЩФмБфаЁ
C.дк20.00mLХЈЖШОљЮЊ0.100 mol/LЕФHClгыCH3COOHЛьКЯШмвКжаЕЮМг0.200mol/LNaOHШмвКжСpH=7ЃЌNaOHШмвКЬхЛ§вЛЖЈаЁгк20.00mL
D.pHЃН8ЕФМюадШмвКжавЛЖЈУЛгаCH3COOHЗжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊдк1ЁС105 PaЁЂ298 KЬѕМўЯТЃЌ2 molЧтЦјШМЩеЩњГЩЫЎеєЦјЗХГі484 kJШШСПЃЌЯТСаШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧ(ЁЁЁЁ)
A.H2O(g)= H2(g)ЃЋ![]() O2(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
O2(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
B.2H2(g)ЃЋO2(g)= 2H2O(l)ЁЁІЄHЃНЃ484 kJЁЄmolЃ1
C.H2(g)ЃЋ![]() O2(g)= H2O(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
O2(g)= H2O(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
D.2H2(g)ЃЋO2(g)= 2H2O(g)ЁЁІЄHЃН484 kJЁЄmolЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩгкОпгаГЌЕЭКФЕчСПЁЂЪйУќГЄЕФЬиЕуЃЌLEDВњЦЗдНРДдНЪмШЫЛЖгЁЃШчЭМЪЧЧтбѕШМСЯЕчГиЧ§ЖЏLEDЗЂЙтЕФзАжУЁЃ
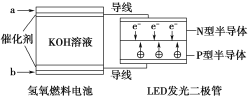
ЂйaДІЭЈШыЕФЦјЬхЪЧЧтЦјЃЌbДІЭЈШыЕФЦјЬхЪЧбѕЦјЃЛ
ЂкИУзАжУжажЛЩцМАСНжжаЮЪНЕФФмСПБфЛЏЃЛ
ЂлЕчГие§МЋЕФЕчМЋЗДгІЪНЮЊO2ЃЋ2H2OЃЋ4e-=4OH-ЃЛ
ЂмPаЭАыЕМЬхСЌНгЕФЪЧЕчГиИКМЋЁЃЩЯЪіЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
A.ЂйЂкB.ЂйЂлC.ЂлЂмD.ЂкЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкГЃбЙЃЌRu/TiO2ДпЛЏЯТЃЌCO2КЭH2ЛьКЯЦјЬх(ЬхЛ§БШ1:4ЃЌзмЮяжЪЕФСПa mol)НјааЗДгІЃЌВтЕУCO2зЊЛЏТЪЁЂCH4КЭCOбЁдёадЫцЮТЖШБфЛЏЧщПіЗжБ№ШчЯТЭМЫљЪО(бЁдёад:зЊЛЏЕФCO2жаЩњГЩCH4ЛђCOЕФАйЗжБШ)ЁЃ
ЗДгІI CO2(g)+4H2(g) CH4(g) + 2H2O(g) ЁїH1
ЗДгІII CO2(g) + H2(g) CO(g) + H2O(g) ЁїH2
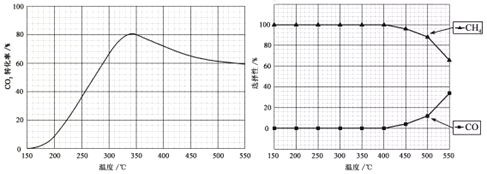
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A.ЁїH1аЁгкСу
B.ЮТЖШПЩгАЯьВњЮяЕФбЁдёад
C.CO2ЦНКтзЊЛЏТЪЫцЮТЖШЩ§ИпЯШдіДѓКѓМѕЩй
D.ЦфЫћЬѕМўВЛБфЃЌНЋCO2КЭH2ЕФГѕЪМЬхЛ§БШИФБфЮЊ1:3ЃЌПЩЬсИпCO2ЦНКтзЊЛЏТЪ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊAЕФВњСПЭЈГЃгУРДКтСПвЛИіЙњМвЕФЪЏгЭЛЏЙЄЫЎЦНЃЌГЃгУзїЫЎЙћДпЪьМСЃЌЯжвдAЮЊжївЊдСЯКЯГЩвЛжжОпгаЙћЯуЮЖЕФЮяжЪEЃЌЦфКЯГЩТЗЯпШчЭМЫљЪОЁЃ

вбжЊЃКШЉПЩбѕЛЏЩњГЩєШЫсЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉаДГіЯТСаЮяжЪЕФНсЙЙМђЪНЃКA___ЃЛE___ЁЃ
ЃЈ2ЃЉаДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪНЃЌВЂзЂУїЗДгІРраЭЃК
Ђй___ЁЂ___ЃЛ
Ђк___ЁЂ___ЃЛ
Ђм___ЁЂ___ЃЛ
ЃЈ3ЃЉШєЯыНЋBжБНгзЊЛЏЮЊDЃЌПЩМгШыЕФЮяжЪЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com