
下列有关实验装置进行的相应实验,能达到实验目的的是

A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去中NO的NO2
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
科目:高中化学 来源:2014-2015山东省枣庄市高一上学期期末化学试卷(解析版) 题型:选择题
下列说法中正确的是

A.40K与40Ca原子中的中子数相等
B.互为同位素的两种核素,它们原子核内的质子数一定相等
C.人们发现了112种元素,即共有112种核素
D.原子结构模型演变历史可以表示为上图
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:填空题
(14分)A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素。其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子。请回答下列有关问题:
(1)写出E的基态原子的价层电子排布式 ;
(2)AB2的水化物中A的杂化方式为 ,CD2的空间构型为 ;
(3)K3[E(CN)6](此处C为碳元素符号)中配位数为 ,配体的电子式为 ;
(4)某矿石主要成分甲的晶胞如图,甲能与水反应,则甲的化学式为 ,属于 晶体;

(5)CD2与CB3可以合成广泛用于有机合成的化合物CBD2,同时得到另一种与臭氧互为等电子体的化合物,写出该反应的化学方程式 ;
(6)纳米颗粒E3B4在磁性录像带、磁性存储器、磁性光盘、铁氧体磁芯、波导管和变压器等方面应用广泛,制取该颗粒时,将0.3mol/L ESO4 的水溶液和0.4mol/L ECl3的水溶液以体积比2∶1进行混合。根据E3B4的组成分析按此用量混合可能的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是

A.原子半径Z>Y
B.X的最简单气态氢化物的热稳定性比Z的强
C.M与Z形成的化合物中只存在离子键
D.M的最高价氧化物对应水化物不能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
某实验小组用下图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

反应原理:
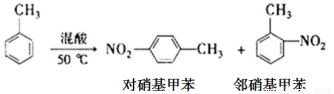
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
相关物质的性质如下:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(1)仪器A的名称是________。
(2)配制混酸的方法是 。
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是: 。
(4)本实验采用水浴加热,水浴加热的优点是 。
(5)分离反应后产物的方案如下:

操作1的名称是 ,操作2中不需要用到下列仪器中的 。(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为________(结果保留小数点后一位数字)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:填空题
(14分)、资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g)
C H4 (g)+2 H2O(g)
向一容积为 2 L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________________。 200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)0。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能 b、太阳能转化为电能
c、太阳能转化为化学能 d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-
则阳极的电极反应式为__________________ _。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:r(Z)> r(R)> r(X) > r(Y)
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月月考理综化学试卷(解析版) 题型:实验题
(15分)亚氯酸钠(NaClO2 )是一种高效漂白剂和强氧化剂。某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:

回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、 、 。
(2)实验须使NaClO3稍微过量,目的是 。
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 。
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2—,则另一种为 。
(5)B中反应的离子方程式为 。
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入 (填序号,下同)酸化,再加入 检验。
①稀HNO3
②稀H2SO4
③K2SO3溶液
④BaCl2溶液
⑤FeCl2溶液
⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9 g NaClO2·3H2O(式量:144.5),至少需 g NaClO3(式量:106.5)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:推断题
【选修5—有机化学基础】(12分)石油化工的重要原料CxHy 可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图:
可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图:

已知:
Ⅰ.下列反应中R、 代表烃基
代表烃基
Ⅱ.J的分子式为C4H4O4,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称____________。
(2)下列说法正确的是_________________________。
a.CxHy和苯都能使溴水褪色,原理相同
b.反应②和反应④的反应类型均为加成反应
c.C能与Na、NaOH、NaHCO3反应
d.E是一种水溶性很好的高分子化合物
e.J在酸性或碱性环境中均能水解
(3)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2molCO2气体,符合条件的K结构有_____________种。
(4)写出反应⑤的化学方程式_________________。
(5)D有多种同分异构体,与D具有相同官能团的还有_____________种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com