
【题目】资料显示“O2 的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应。实验如下:
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2mL1mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2mL1mol/LKI 溶液+5滴淀粉+1mL0.1mol/L HCl | 溶液变蓝 | |
③2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol/L KCl | 无明显变化 | |
④2mL1mol/LKI溶液+5滴淀粉+1mL0.1mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
下列说法不正确的是
A. 通过小烧杯中溶液颜色的变化证明反应的发生
B. ③是验证Cl-是否影响KI与O2的反应
C. ④说明CH3COOH 是弱酸,因为和盐酸同浓度同温度的情况下,电离出 c(H+)浓度低
D. 此实验还可以增加2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol·L-1NaOH 溶液这一步骤
【答案】D
【解析】A. 溶液变蓝,说明生成碘单质,反应的离子的方程式为:4I-+O2+4H+=2I2+2H2O,可以通过小烧杯中溶液颜色的变化证明反应的发生,故A正确;B. 根据实验2和实验3的所加试剂的区别可知,实验3是对照实验,验证Cl-是否影响KI与O2的反应,故B正确;C. 盐酸是强电解,而醋酸是弱电解质,同浓度的两种酸氢离子浓度不同,所以其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱,故C正确;D.即使生成了碘单质,碘单质能够迅速与氢氧化钠溶液反应,也看不到明显的现象,因此没有必要增加2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol·L-1NaOH 溶液这一步骤,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】I.如图所示为常见玻璃仪器的部分结构:
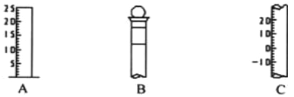
(1)请写出所列仪器的名称: A______,B_______,C_______;
(2)仪器 B 使用前必须__________________。
(3)仪器 B 上标记有______(填序号);①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
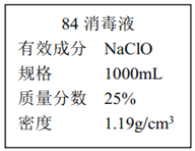
(1)该“84 消毒液”的物质的量浓度约为_______mol·L-1。(保留两位有效数字)
(2)某同学取100 mL该“84 消毒液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=_____。
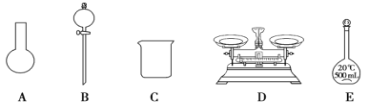
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是________(填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
(4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为______ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁中含有Fe2+ , 现榨的苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
A.氧化性
B.还原性
C.碱性
D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量盐酸中,为了除去杂质需调节溶液的pH到4,应加入的试剂是( )
A. ZnCl2 B. ZnO C. NaOH D. NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)常用作粮食熏蒸剂,制取反应为 CO(g)+H2S(g) ![]() COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
实验 | 温度/℃ | n起始/mol | 平衡时 | 所需时间 | |||
CO | H2S | COS | H2 | n(CO)/mol | min | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 | e |
2 | 150 | 7.0 | 7.0 | 3.0 | 3.0 | a | f |
3 | 200 | 20.0 | 20.0 | 0 | 0 | 16.0 | g |
下列说法错误的是
A. 实验1 反应开始到平衡整个过程中放出的热量为 90kJ
B. 实验2 达平衡时,a>7.0
C. 实验3 时间:g<e
D. 实验3 CO 达到平衡时的转化率比实验1 小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH1 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH2
则 NH3(g)的标准燃烧热Δ H=__________________。
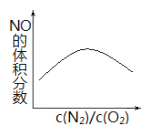
(2)高温下,N2(g)+O2(g)![]() 2NO(g), ΔH<0,反应达到平衡时混合气体中NO的体积分数与反应物中 c(N2)/c(O2)的比值的关系如图,请在右图上画出适当降温后,反应达到平衡时混合气体中 NO 的体积分数与反应物中 c(N2)/c(O2)的比值的关系图。_______
2NO(g), ΔH<0,反应达到平衡时混合气体中NO的体积分数与反应物中 c(N2)/c(O2)的比值的关系如图,请在右图上画出适当降温后,反应达到平衡时混合气体中 NO 的体积分数与反应物中 c(N2)/c(O2)的比值的关系图。_______
(3)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。
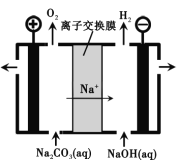
①电解的总反应式___________________________。
②已知H2CO3的Ka1=4.30×10-7, Ka2=5.60×10-11, 当同浓度的稀NaHCO3和稀Na2CO3溶液以2∶1体积比混合后,混合液的c(H+)约为____________ mol·L-1。
(4)为测定某NaNO2 溶液的物质的量浓度, 准确量取10.00mLNaNO2 溶液样品与24.00mL 0.05000mol·L-1 过量的酸性KMnO4 溶液充分反应,反应后所得溶液用0.1000mol/L(NH4)2Fe(SO4)2 标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2 溶液 10.00mL。 终点的现象_____________________,通过计算确定NaNO2 溶液的物质的量浓度___________ mol·L-1。
有关反应式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O; 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(分子中含有三个氧原子)主要存在于距地球表面20公里的同温层下部的臭氧层中,它吸收对人体有害的短波紫外线。下列元素与氧元素处于同一主族的是 ( )
A.HeB.SC.SiD.P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下能大量共存,并可用浓硫酸干燥的一组气体是( )
A.SO2、HI、N2B.O2、CO2、NO
C.NH3、N2、H2D.O2、H2、SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com