
【题目】(1)已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH1 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH2
则 NH3(g)的标准燃烧热Δ H=__________________。
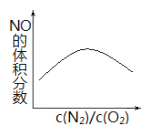
(2)高温下,N2(g)+O2(g)![]() 2NO(g), ΔH<0,反应达到平衡时混合气体中NO的体积分数与反应物中 c(N2)/c(O2)的比值的关系如图,请在右图上画出适当降温后,反应达到平衡时混合气体中 NO 的体积分数与反应物中 c(N2)/c(O2)的比值的关系图。_______
2NO(g), ΔH<0,反应达到平衡时混合气体中NO的体积分数与反应物中 c(N2)/c(O2)的比值的关系如图,请在右图上画出适当降温后,反应达到平衡时混合气体中 NO 的体积分数与反应物中 c(N2)/c(O2)的比值的关系图。_______
(3)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。
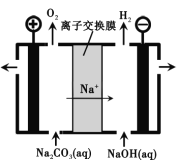
①电解的总反应式___________________________。
②已知H2CO3的Ka1=4.30×10-7, Ka2=5.60×10-11, 当同浓度的稀NaHCO3和稀Na2CO3溶液以2∶1体积比混合后,混合液的c(H+)约为____________ mol·L-1。
(4)为测定某NaNO2 溶液的物质的量浓度, 准确量取10.00mLNaNO2 溶液样品与24.00mL 0.05000mol·L-1 过量的酸性KMnO4 溶液充分反应,反应后所得溶液用0.1000mol/L(NH4)2Fe(SO4)2 标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2 溶液 10.00mL。 终点的现象_____________________,通过计算确定NaNO2 溶液的物质的量浓度___________ mol·L-1。
有关反应式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O; 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
【答案】 ΔH=(2ΔH1+3ΔH2)/20 kJ·mol-1  Na2CO3+H2O
Na2CO3+H2O![]() NaOH+NaHCO3 1.12×10-10mol·L-1 紫色刚好褪去,且半分钟内不变色 0.2500mol·L-1
NaOH+NaHCO3 1.12×10-10mol·L-1 紫色刚好褪去,且半分钟内不变色 0.2500mol·L-1
【解析】(1)①4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH1,② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH2
根据盖斯定律,将①×2+②×3得:20NH3(g)+15O2(g)= 10N2(g)+30H2O(l) ΔH=(2ΔH1+3ΔH2) kJ·mol-1,则NH3(g)的标准燃烧热Δ H=(2ΔH1+3ΔH2)/20 kJ·mol-1,故答案为:(2ΔH1+3ΔH2)/20 kJ·mol-1;
(2)在相同的c(N2)/c(O2)条件下,降低温度,平衡正向移动,NO的体积分数增大,因此图像为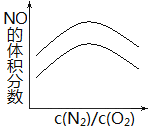 ,故答案为:
,故答案为: ;
;
(3)①根据图示,阳极区水电离的氢氧根离子放电生成氧气,剩余的氢离子与碳酸根离子反应生成碳酸氢根离子,阴极区溶液中水电离的氢离子放电生成氢气,剩余的氢氧根离子与转移过来的钠离子结合生成氢氧化钠,因此电解Na2CO3溶液可以生成NaHCO3和NaOH,同时电解水生成了氢气和氧气,则电解Na2CO3溶液的总反应式为Na2CO3+H2O![]() NaOH+NaHCO3,故答案为:Na2CO3+H2O
NaOH+NaHCO3,故答案为:Na2CO3+H2O![]() NaOH+NaHCO3;
NaOH+NaHCO3;
②同浓度的稀NaHCO3和稀Na2CO3溶液以2∶1体积比混合后溶液显碱性,以碳酸钠的水解为主,因为碳酸钠的水解平衡常数=![]() =
=![]() ×10-3 mol/L =
×10-3 mol/L =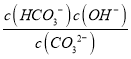 ≈
≈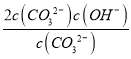 =2 c(OH-),因此c(OH-)=
=2 c(OH-),因此c(OH-)=![]() ×10-3 mol/L,则c(H+)=
×10-3 mol/L,则c(H+)=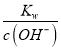 =1.12×10-10mol·L-1,故答案为:1.12×10-10mol·L-1;
=1.12×10-10mol·L-1,故答案为:1.12×10-10mol·L-1;
(4)滴定反应的方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,当紫色刚好褪去,且半分钟内不变色,说明达到了滴定终点;根据5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可知,与(NH4)2Fe(SO4)2 标准溶液反应的高锰酸钾为0.01L×0.1000mol/L×![]() =2×10-4mol,则与NaNO2 溶液反应的高锰酸钾为0.02400L×0.05000mol·L-1 -2×10-4mol=0.001mol,根据5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,NaNO2 溶液的物质的量浓度==0.25 mol·L-1,故答案为:紫色刚好褪去,且半分钟内不变色;0.2500mol·L-1。
=2×10-4mol,则与NaNO2 溶液反应的高锰酸钾为0.02400L×0.05000mol·L-1 -2×10-4mol=0.001mol,根据5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,NaNO2 溶液的物质的量浓度==0.25 mol·L-1,故答案为:紫色刚好褪去,且半分钟内不变色;0.2500mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“O2 的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应。实验如下:
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2mL1mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2mL1mol/LKI 溶液+5滴淀粉+1mL0.1mol/L HCl | 溶液变蓝 | |
③2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol/L KCl | 无明显变化 | |
④2mL1mol/LKI溶液+5滴淀粉+1mL0.1mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
下列说法不正确的是
A. 通过小烧杯中溶液颜色的变化证明反应的发生
B. ③是验证Cl-是否影响KI与O2的反应
C. ④说明CH3COOH 是弱酸,因为和盐酸同浓度同温度的情况下,电离出 c(H+)浓度低
D. 此实验还可以增加2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol·L-1NaOH 溶液这一步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(已知H2C2O4中的碳为+3价)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。试回答下列问题。
(1)该反应中氧化产物的化学式是___________;被还原的元素是___________。
(2)用双线桥标出上述反应的电子转移情况______。
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
(3)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_________mol,消耗还原剂的物质的量为___________mol。
(4)标准状况下44.8mL的ClO2气体恰好能与50mL 0.1mol·L-1的Na2SO3溶液液完全反应,生成Na2SO4,氯元素在产物中的化合价为___________;此过程说明ClO2具有____(填“氧化”或“还原”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO3+S+3C=K2S+N2↑+3CO2↑,该反应中被还原的元素是( )
A.C
B.N
C.N和S
D.N和C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.严格执行机动车尾气排放标准有利于防止大气污染
B.使用二氧化硫增白的食品对人体健康产生损害
C.使用氯气对自来水消毒时生成的有机氯化物可能对人体有害
D.食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是一种治疗急性脑缺血的药物,部分合成流程如下。下列说法正确的是( )
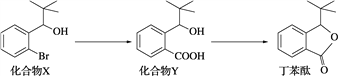
A. 化合物X、Y和丁苯酞三种分子中各含有1个手性碳原子
B. 化合物Y可以发生取代、加成和加聚反应
C. 可用Na2CO3溶液鉴别化合物X和化合物Y
D. 化合物X、Y和丁苯酞各1 mol最多消耗NaOH的量均为1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com