
【题目】设阿伏加德罗常数的值为NA。已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH+2CO2↑。下列说法正确的是( )
2CH3CH2OH+2CO2↑。下列说法正确的是( )
A. 0.1 mol葡萄糖(C6H12O6)含羟基(—OH)数目为0.6NA
B. 10.0 g质量分数为46%的酒精与足量的钠反应产生氢分子数为0.05NA
C. 常温常压下,4.48 L CO2和NO2的混合气体含原子总数为0.6NA
D. 4.8 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
科目:高中化学 来源: 题型:
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
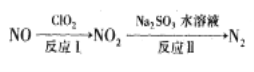
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____(填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8molL﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
A. c(H+) +c(HSO3-) +2c(H2SO3) =c(OH-)
B. c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C. c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-)
D. 升高温度,溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙罗特美是一种长效平喘药,其合成的部分路线如下:
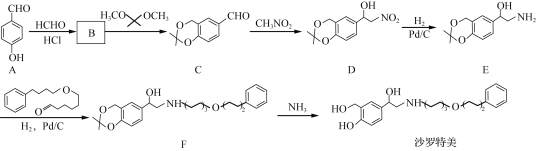
(1)F中的含氧官能团名称为____________(写两种)。
(2)C→D的反应类型为____________。
(3)B的分子式为C8H8O3,与(CH3)2C(OCH3)2发生取代反应得到物质C和CH3OH,写出B的结构简式:________。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:__________。
①分子中含有苯环,且有一个手性碳原子,不能与FeCl3发生显色反应;
②能发生水解反应,水解产物之一是α氨基酸,另一含苯环的水解产物分子中只有3种不同化学环境的氢。
(5)请写出以 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组进行如下实验:
Ⅰ.探究反应速率的影响因素 设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L - 1 H2C2O4溶液、0.010 mol·L -1KMnO4 溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽

(1)若上述实验②、③是探究浓度对化学反应速率的影响,则 a 为______________;乙是实验需要测量的物理量,则表格中“乙”应 填写__________________。
Ⅱ.测定 H2C2O4·xH2O 中 x 值 已知:M(H2C2O4)=90 g·mol-1 ① 称取 1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液; ② 取 25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4; ③ 用浓度为 0.05 000 mol·L -1 的 KMnO4 标准溶液进行滴定。
反应原理为:5 H2C2O4 + 2 MnO4— + 6H+ = 10CO2↑+ 2Mn2+ + 8H2O
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是________(选填 a、b)。由图可知消耗 KMnO4 溶液体积为________ mL。

(3)滴定终点锥形瓶内现象为__________________________________________________。
(4)通过上述数据,求得 x=______________。
(5)下列操作会造成所测x偏大的是____________(填字母)。
A.滴定终点俯视读数
B.锥形瓶用待测溶液润洗
C.滴定前有气泡,滴定后没有气泡
D.配制100mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。向K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
2CrO42-(黄色)+2H+。向K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
A. 加入X溶液,上述平衡正向移动
B. Cr2O72-的物质的量浓度增大
C. X溶液可能是NaOH溶液
D. 再加入H2SO4,可使黄色溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作。回答下列问题:

(1)试剂Ⅰ的化学式为_______。
(2)试剂Ⅱ的化学式为_______,②中加入试剂Ⅱ的目的是除去A中的____,检验该离子已经除尽的方法是________________________________________________________。
(3)③中发生反应的化学方程式为_________________________________________________。
(4)由E得到KCl晶体的实验操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com