
【题目】有关萃取操作的说法中,不正确的是( )
A.实验使用的主要仪器是分液漏斗
B.溶质溶于萃取剂中所得的溶液不一定有颜色
C.溶质在萃取剂中的溶解度比在原溶剂中的溶解度大
D.CCl4、苯、汽油、酒精均可萃取碘水中的碘
科目:高中化学 来源: 题型:
【题目】某液态烃的分子式为CmHn,相对分子质量为H2的39倍。它不能使酸性高锰酸钾溶液褪色,不能使溴的四氯化碳溶液因反应而褪色。在催化剂存在时,7.8 g该烃能与0.3 mol H2发生加成反应生成相应的饱和烃CmHp。则
(1)m、n、p的值分别是m=________,n=________,p=________。
(2)CmHp的结构简式是__________________。
(3)CmHn能和浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是___________________,
该反应属于________反应,有机产物的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.某元素从化合态变成游离态,该元素一定被还原
C.由同种分子构成的物质一定是纯净物
D.电离时能生成H+的化合物一定是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的说法正确的是( )
A.有单质生成的化学反应,一定是氧化还原反应
B.金属单质在氧化还原反应中只能作还原剂
C.有非金属单质参加的化合反应,非金属单质一定是氧化剂
D.有气体生成的化学反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中可逆反应 A2(g)+3B2(g)![]() 2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是
2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是

A. 加入催化剂可以使状态 d 变为状态 b
B. 若 T1>T2,则逆反应一定是放热反应
C. 达到平衡时 A2 的转化率大小为: b>a>c
D. 在T2 和n(A2)不变时达到平衡,AB3 的物质的量大小为: c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
pH=8![]()
![]()
![]()
![]()
(1)实验①可说明________(填字母)。
a.该Na2S2O3溶液中水电离的c(OH-)=10-8mol·L-1
b.H2S2O3是一种弱酸
c.Na2S2O3是一种弱电解质
d.Na2S2O3的水解方程式为S2O![]() +2H2OH2S2O3+2OH-
+2H2OH2S2O3+2OH-
(2)写出实验②发生反应的离子方程式:_____________________________。
(3)Na2S2O3溶液中加入盐酸有淡黄色沉淀和刺激性气味的气体生成,写出该反应的离子方程式:_________________________________。
(4)实验室制得的Na2S2O3·5H2O粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般在酸性条件下用KMnO4标准溶液滴定(假设粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g粗样品溶于水,用0.40 mol·L-1 KMnO4标准溶液(加入适量硫酸酸化)滴定,当溶液中S2O![]() 全部被氧化时,消耗KMnO4溶液体积20.00 mL(5S2O
全部被氧化时,消耗KMnO4溶液体积20.00 mL(5S2O![]() +8MnO
+8MnO![]() +14H+===8Mn2++10SO
+14H+===8Mn2++10SO![]() +7H2O)。试回答:
+7H2O)。试回答:
①此滴定实验是否需要指示剂?_______(填“是”或“否”)。KMnO4溶液置于________(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,中国使用铜的历史年代久远。大约在六、七千年以前中国人的祖先就发现并开始使用铜。纯铜是柔软的金属,呈紫红色,延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,请回答下列问题:
(1)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______(填选项字母)
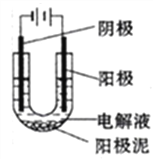
a.粗铜接电源正极,发生氧化反应
b.溶液中Cu2+向阴极移动
c.电解过程中,阳极和阴极的质量变化相等
d.利用阳极泥可回收Al、Zn等金属
(2)目前的电路板,主要由线路和图面组成,线路是作为原件之间导通的工具,在设计上会另外设计大铜面作为接地及电源层,在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为______________。
(3) Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式___________________。
(4)Cu2O中的Cu+不稳定,向Cu2O滴加稀硫酸,有紫红色物质生成,溶液变为蓝色,写出反应的离子方程式_________________。
(5)火法炼铜的原理:Cu2+O2![]() 2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com