
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ������������ͼ���ش��������⣺ 
��1��ClO2�ķе�Ϊ283K����ClO2�ֽⱬը��һ����ϡ����������ϡ�͵�10%���¸���ȫ��д������Ӧ������������ClO2�Ļ�ѧ����ʽ ��
��2����β�����ա������ա���⡱�����ų�������ClO2 ��
����β�����չ����У��ɴ���H2O2���Լ���������ţ���
A��Na2O2B��Na2S C��FeCl2D��KMnO4
�����β��������Ч�ʵĿ��д�ʩ��������ţ���
A��β������ʱ��ֽ�������ҺB���ʵ��ӿ�β����ͨ������C�����¶ȿ�����20������D����ˮϡ��β������Һ
�۴����շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ ��
��3���ڼ�����Һ��NaClO2�Ƚ��ȶ�����������Һ�У�ClO2����H+��ΪHClO2 �� HClO2
��Ψһ����±�ᣬ���ȶ����ֽ����Cl2��ClO2��H2O��д��HClO2�ֽ�Ļ�ѧ����ʽ�� ��
��4����֪NaClO2���ܽ�����¶����߶�����NaClO2������Һ��38������60�����»�����NaClO2 �� ��NaClO2���������п��ܻ��е����������ѧʽ����
���𰸡�
��1��2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2
��2��C��AC��2��1
��3��8HClO2=Cl2��+6ClO2��+4H2O
��4��NaCl��Na2SO4
���������⣺��1��NaClO3��SO2��H2SO4�ữ����������ClO2 �� ����NaClO2������������ԭ����ΪNaCl�����ղ���ΪNaHSO4 �� ˵�������������ƣ��Ҳ���ClO2 �� ���ݵ����غ��֪���˷�Ӧ�Ļ�ѧ����ʽΪ��2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2 ��
���Դ��ǣ�2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2����2������β�����չ����У��������������������Һ����ClO2 �� ����ΪClO2�� �� ��H2O2Ϊ��ԭ�����ֲ��������µ����ʣ����Կɴ���H2O2���Լ���Na2O2 �� ��ѡ��A��
�����β��������Ч�ʣ�����Խ��衢����β����ͨ�����ʡ���������ҺŨ�ȣ���ClO2�ķе�Ϊ283K�����Խ��¶ȿ�����20������Ҳ�������β��������Ч�ʣ���ѡ��AC��
����ͼ��֪�����ú��������������������Һ����ClO2 �� ����ΪClO2�� �� ��˷�Ӧ��ClO2Ϊ����������ԭ����ΪClO2�� �� ���ϼ۴�+4�۽�Ϊ+3�ۣ�H2O2Ϊ��ԭ������������ΪO2 �� ÿĦ��H2O2�õ�2mol���ӣ����ݵ����غ��֪�������ͻ�ԭ�������ʵ���֮��Ϊ2��1��
���Դ��ǣ�2��1����3��HClO2���ȶ����ֽ����Cl2��ClO2��H2O�����ݵ����غ��֪���ֽ�Ļ�ѧ����ʽΪ8HClO2=Cl2��+6ClO2��+4H2O�����Դ��ǣ�8HClO2=Cl2��+6ClO2��+4H2O����4�����Ʊ����̿�֪�����������ΪClO2�Ͷ���SO2���壬�������ú��������������������Һ����β��ClO2�Ͷ���SO2���壬����ΪClO2�� �� ��������Na2SO4 �� �������ᾧ���������Һ���˺�NaClO2������NaCl��Na2SO4 �� ��NaCl��Na2SO4 ���ܽ�����¶����߶���������38������60�����»�����NaClO2ʱ���ܻ��е�������NaCl��Na2SO4 �� ���Դ��ǣ�NaCl��Na2SO4 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������������A��B��C��D��E��F����Ԫ�ء�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�E��Cλ��ͬһ���壬F��ԭ������Ϊ29��
��1��F��̬ԭ�ӵĺ�������Ų�ʽΪ______________________��
��2����A��B��C����Ԫ���У���һ��������С�����˳����___________����Ԫ�ط��Żش𣩡�
��3��Ԫ��B�ļ���̬�⻯��ķе�___________������������������������Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ����______________________��
��4����A��B��C�γɵ�����CAB��AC2��Ϊ�ȵ����壬��CAB�ĽṹʽΪ___________��
��5����B��C��D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ___________��

��6��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��ѧ��Ӧ���ʱ��뷴Ӧ��;���й�
B.�����£�ϡ��0.1molL��1CH3COOH��Һ����Һ�ĵ�����������
C.���³�ѹ�£�22.4L Cl2�к��еķ�����Ϊ6.02��1023��
D.��������ͭ��a��b����;����ȫת��ΪCu��NO3��2 �� ;��a��b���ĵ�����һ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�KOH��Һʱ������Ũ��ƫ�͵�ԭ������ǣ� ��
A.����ƿ��ԭ������������ˮ
B.��Һʱ��������Һ������ƿ��
C.����ƿʢ��KOH��Һ��ʹ��ǰδϴ��
D.����ʱ���ӿ̶��ߺ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��������ݻ���Ϊ2.0L�ĺ����ܱ������з�����Ӧ��2NO��g��+2CO��g��N2��g��+2CO2��g��
����������ʼ���ʵ����뷴Ӧ�¶����±���ʾ����Ӧ�����мס���������CO2�����ʵ�����ʱ��仯��ϵ����ͼ��ʾ��
���� | �¶�/�� | ��ʼ���ʵ���/mol | |
NO ��g�� | CO ��g�� | ||
�� | T1 | 0.20 | 0.20 |
�� | T1 | 0.30 | 0.30 |
�� | T2 | 0.20 | 0.20 |
����˵����ȷ���ǣ� ��
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�ﵽƽ��ʱ������CO2����������ȼ��е�С
C.T1��ʱ������ʼʱ����г���0.40 mol NO��0.40mol CO��0.40mol N2��0.40mol CO2 �� ��Ӧ�ﵽ��ƽ��ǰv��������v���棩
D.T2��ʱ������ʼʱ����г���0.06mol N2��0.12 mol CO2 �� ���ƽ��ʱN2��ת���ʴ���40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(C1NO)���л��ϳ��е���Ҫ�Լ�������NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ2NO(g)+C12(g)![]() 2C1NO(g)��
2C1NO(g)��
��1�����������������ڴ����еĺ������������ʱ�������������ȣ��漰���·�Ӧ��
�� 2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
�� 4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
�� 2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
��K1��K2��K3֮��Ĺ�ϵΪK3=______________��
��2����֪���ֻ�ѧ���ļ����������±�(�������ȵĽṹΪCl-N=O):

��2NO(g)+C12(g)![]() 2C1NO(g)��Ӧ����H��a�Ĺ�ϵΪ��H=________kJ/mol��
2C1NO(g)��Ӧ����H��a�Ĺ�ϵΪ��H=________kJ/mol��
��3����1L�ĺ����ܱ������г���2molNO(g)��1molC12(g)���ڲ�ͬ�¶��²��c(C1NO)��ʱ��Ĺ�ϵ��ͼA:

�� ��ͼA���ж�T1 ________T2���÷�Ӧ����H________0 (����>����<������=��)��
�� ��Ӧ��ʼ��10minʱNO��ƽ����Ӧ����v(NO)=____________mol/(L��min)��
�� T2ʱ�÷�Ӧ��ƽ�ⳣ��K=____________��
��4�� һ���������ں��º��ݵ��ܱ������а�һ����������NO(g)��Cl2(g)��ƽ��ʱClNO�����������n(NO)/n(C12)�ı仯ͼ����ͼB����A��B��C��״̬�У�NO��ת����������________�㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����ȼ�ϵ��ԭ��ʾ��ͼ�����մ�ͼ����ʾ���ش��������� 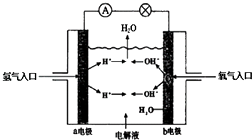
��1��a�缫Ϊ����b�缫Ϊ��
��2��д���õ�صĵ缫��Ӧ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ժʿ����Ժʿѧ��ͬ���ġ����ӹ��������ն�����������ˣ�ȫ������������Ϸ˵��BF3��TiO2��HCHO��N2O����ï����NH3��HCN��H2S��O3�������ϩ���Ƶ��ڶࡰ���ӹ������е����ǣ�
��1��д��Fe3+�Ļ�̬��������Ų�ʽ ��
��2��HCHO������̼ԭ�ӹ�����ӻ��������Ϊ��1mol HCN�����к��ЦҼ�����ĿΪmol��
��3��N2O�Ŀռ乹��Ϊ �� ��N2O���ֵȵ������һ������Ϊ ��
��4��TiO2����Ȼ�����У����ȶ���һ�־���ṹ��ͼ��������ʾԭ�ӣ� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����������ȷ���ǣ� ��
A.��ѧ��������ԭ��֮�䣬Ҳ�ܴ����ڷ���������֮��
B.����ԭ��֮�������ý�����ѧ��
C.���Ӽ�������������֮���������
D.��ѧ��ͨ��ָ����������������ԭ��֮��ǿ�ҵ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com