
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(2)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
A.Ba(OH)2溶液 | B.BaCl2溶液 |
C.NaOH溶液 | D.澄清的石灰水 |
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。
【答案】HCO3-+H2O![]() H2CO3+OH- 大于 乙 B 乙 常压下加热NaHCO3的水溶液,溶液温度达不到150 ℃
H2CO3+OH- 大于 乙 B 乙 常压下加热NaHCO3的水溶液,溶液温度达不到150 ℃
【解析】
(1)甲认为碳酸氢钠是强碱弱酸的酸式盐,能水解导致溶液呈碱性,水解方程式为HCO3-+H2O![]() H2CO3+OH-。碳酸钠是强碱弱酸盐,能水解,因为碳酸根离子的水解第一步远远大于第二步,所以碳酸钠的水解程度大于碳酸氢钠的水解程度。
H2CO3+OH-。碳酸钠是强碱弱酸盐,能水解,因为碳酸根离子的水解第一步远远大于第二步,所以碳酸钠的水解程度大于碳酸氢钠的水解程度。
(2)碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡,向碳酸氢钠或碳酸钠中加氢氧化钡或氢氧化钙都反应生成白色沉淀,向碳酸钠或碳酸氢钠中加入氢氧化钠虽然反应但不产生明显现象。
(3)碳酸氢钠的分解温度为150℃,常压下加入碳酸氢钠溶液,溶液的温度不能达到150℃,所以碳酸氢钠不分解,溶液仍为碳酸氢钠溶液,由此判断乙是错误的。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度
B.HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C.燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D.S燃烧热的热化学方程式为S(s)+![]() O2(g)=SO3(g) ΔH=315 kJ·mol-1
O2(g)=SO3(g) ΔH=315 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
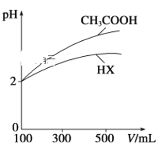
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )

A. γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B. α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D. 三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl﹣、SO42﹣)中回收氧化铁流程如图:

已知:常温下Ksp[Mg(OH)2]=1.2×10﹣11; Ksp[Fe(OH)2]=2.2×10﹣16;Ksp[Fe(OH)3]=3.5×10﹣38;Ksp[Al(OH)3]=1.0×10﹣33。
(1)写出在该酸性废液中通入空气时发生的离子反应方程式_____。
(2)常温下,根据已知条件在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_____。
(3)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的实验事实正确的是( )
出现环境 | 实验事实 | |
A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
B | 电解CuCl2溶液 | 电子经过负极→阴极 |
C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某吸水材料和聚酯纤维合成路线如图所示:
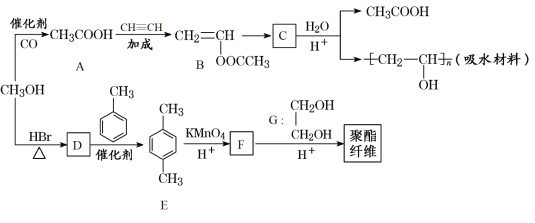
回答下列问题:
(1)B中的官能团名称是_________。
(2)B→C的反应类型是____________。
(3)请写出由CH3OH生成D的化学方程式__________。
(4)E的同分异构体H满足下列条件:①属于芳香族化合物②核磁共振氢谱有四组峰,且峰面积之比为1:1:2:6,则H的结构简式为___________。
(5)写出聚酯纤维的结构简式:_________。
(6)参照上述流程,以苯和乙烯为起始原料,选用必要无机试剂合成对硝基乙苯(![]() ),写出合成路线_______ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。提示:硝基苯一般在间位发生取代,乙苯一般在邻位或对位发生取代。
),写出合成路线_______ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。提示:硝基苯一般在间位发生取代,乙苯一般在邻位或对位发生取代。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com