
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.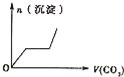
B.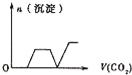
C.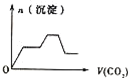
D.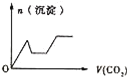
【答案】C
【解析】
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,发生反应先后顺序为Ba(OH)2+CO2=BaCO3↓+H2O、2KOH+CO2=K2CO3+H2O、2KAlO2+CO2+3H2O=2Al(OH)3↓+K2CO3、K2CO3+CO2+H2O=2KHCO3、BaCO3+H2O+CO2=Ba(HCO3)2,据此分析解答。
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,发生反应先后顺序为Ba(OH)2+CO2=BaCO3↓+H2O、2KOH+CO2=K2CO3+H2O、2KAlO2+CO2+3H2O=2Al(OH)3↓+K2CO3、K2CO3+CO2+H2O=2KHCO3、BaCO3+H2O+CO2=Ba(HCO3)2,根据物质的溶解性知,沉淀量与通入二氧化碳关系图为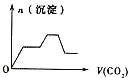 ,答案选C。
,答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用![]() 溶液、尿素
溶液、尿素![]() 为原料制取水合肼
为原料制取水合肼![]() 的流程如下:
的流程如下:
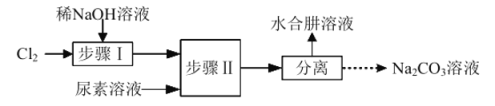
已知:①![]()
②![]() 沸点约
沸点约![]() ,具有强还原性,能与
,具有强还原性,能与![]() 剧烈反应生成
剧烈反应生成![]() 。
。
下列说法错误的是( )
A.步骤Ⅰ、Ⅱ反应过程中需控制好温度
B.所得副产物![]() 可用于工业上吸收
可用于工业上吸收![]() 尾气
尾气
C.步骤Ⅱ具体操作为将尿素溶液逐滴加入![]() 溶液中
溶液中
D.水合肼与![]() 反应的离子方程式为:
反应的离子方程式为:![]() ↑
↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(2)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
A.Ba(OH)2溶液 | B.BaCl2溶液 |
C.NaOH溶液 | D.澄清的石灰水 |
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是( )

A. 图1中,插入海水中的铁棒,越靠近底端,腐蚀越严重
B. 镀层破损后,镀锌铁比镀锡铁更耐用
C. 纯银器表面在空气中因电化学腐蚀渐渐变暗
D. 图2中,金属棒X若为Cu,可使埋在地下的钢管免受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g);ΔH= -270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ
C.在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量
D.该反应中的能量变化可用如图来表示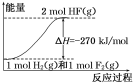
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
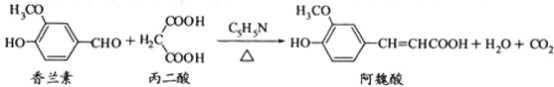
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.1mol香兰素最多可以与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4溶液25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入几滴酚酞做指示剂
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管,调整液面,记下开始读数
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
滴定操作的正确顺序是(用序号填写)_______________。
(2)在D操作中应该调整液面到_________________,并使尖嘴处_____________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是__________________。
(4)滴定到终点时锥形瓶内溶液的pH约为________;终点时颜色变化是____________。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
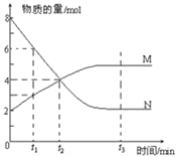
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知稀溶液中①H+(aq)+OH-(aq)![]() H2O(l) △H1=-57.3kJ·mol-1;
H2O(l) △H1=-57.3kJ·mol-1;
②![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)=![]() BaSO4(s)+H2O(l) △H2下列结论正确的是
BaSO4(s)+H2O(l) △H2下列结论正确的是
A.中和反应的△H=-57.3kJmol-1B.△H2<△H1
C.△H2>△H1D.中和热的数值与实际发生反应的酸碱量有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com