
【题目】下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:Al+2OH-=AlO2-+H2↑
B.氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
D.用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑
【答案】D
【解析】
A.铝粉投入到NaOH溶液中,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故A错误;
B.氯气通入水中,生成的HClO是弱电解质,在离子方程式中保留分子式,则正确的反应离子方程式为:Cl2+H2O=H++Cl-+HClO,故B错误;
C.AlCl3溶液中加入足量的氨水,反应生成氢氧化铝沉淀,NH3H2O是弱电解质,在离子方程式中保留分子式,则正确的反应离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,故C错误;
D.用醋酸除水垢的离子反应为2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】甲、乙两种非金属元素:①甲元素形成的单质比乙元素形成的单质易与![]() 化合;②甲元素形成的单质能与乙元素形成的阴离子发生置换反应;③与某金属反应时,甲原子得电子数目比乙的多;④甲元素形成的单质的熔、沸点比乙元素形成的单质的低;⑤甲元素的简单氢化物水溶液的酸性比乙元素的简单氢化物水溶液的酸性强;⑥甲的氧化物的水化物的酸性强于乙的氧化物的水化物的酸性。其中能说明甲元素的非金属性比乙元素强的是( )
化合;②甲元素形成的单质能与乙元素形成的阴离子发生置换反应;③与某金属反应时,甲原子得电子数目比乙的多;④甲元素形成的单质的熔、沸点比乙元素形成的单质的低;⑤甲元素的简单氢化物水溶液的酸性比乙元素的简单氢化物水溶液的酸性强;⑥甲的氧化物的水化物的酸性强于乙的氧化物的水化物的酸性。其中能说明甲元素的非金属性比乙元素强的是( )
A.①②⑥B.①②④⑤C.①②D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4.48L CO2通过一定量的固体过氧化钠后收集到3. 36L气体(气体的测量均在标准状况下),则这3. 36L气体的质量是( )
A.6. 0gB.5. 6gC.4. 8gD.3. 8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案或实验结论不正确的是( )
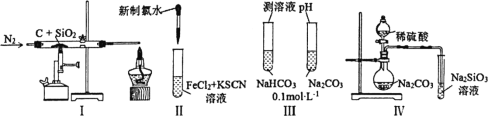
A.图Ⅰ结论,元素非金属性:C>Si
B.图Ⅱ结论,氧化性:Cl2>Fe3+
C.图Ⅲ结论,溶液pH:Na2CO3>NaHCO3
D.图Ⅳ结论,酸性:H2SO4>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如图所示。关于EGC的下列叙述中正确的是 ( )
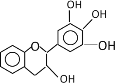
A.分子中所有的原子共面
B.1molEGC与4molNaOH恰好完全反应
C.易发生氧化反应和取代反应,不能发生加成反应
D.遇FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)HX + CH3-CH=CH2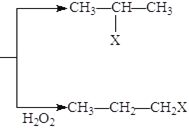 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成结构简式为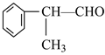 的物质,该物质是一种香料。
的物质,该物质是一种香料。
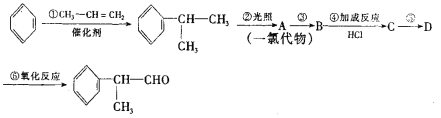
请根据上述路线,回答下列问题:
(1)A的结构简式可能为_________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):____。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是______。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生产聚苯乙烯的流程如下:
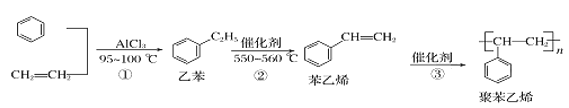
下列叙述正确的是( )
A.苯乙烯是苯的同系物
B.苯乙烯所有原子一定在同一平面内
C.反应①的反应类型是加成反应,反应②的反应类型是取代反应
D.鉴别乙苯与苯乙烯可用Br2的四氯化碳溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
_SiO2+_C+_N2![]() _Si3N4+_CO
_Si3N4+_CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是___,其还原产物是___;
(3)该反应的平衡常数表达式为K=___;
(4)若知上述反应为放热反应,则其反应热△H___0(填“>”、“<”或“=”);升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向___反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L·min),则N2消耗速速率为v(N2)=___mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
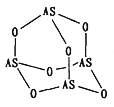
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
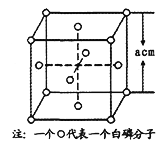
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com