
【题目】熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2﹣和HCO﹣3)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32﹣﹣52e﹣═34CO2+10H2O. 试回答下列问题:
(1)该燃料电池中发生氧化反应的物质是 .
(2)该燃料电池的化学反应方程式为;
(3)某学生想用该燃料电池电解饱和食盐水,写出反应的离子方程式 .
(4)当电路中通过0.26NA的电子时,消耗的氧气的体积(标况)为;此时电解饱和食盐水生成的氯气的物质的量是;若此时溶液体积为200ml,则生成的NaOH的物质的量浓度为 .
【答案】
(1)丁烷
(2)2C4H10+13O2=8CO2+10H2O
(3)2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
(4)1.456L;0.13mol;1.3mol/L
【解析】解:(1)燃料电池中发生氧化反应的物质为负极燃料,所以该燃料电池中发生氧化反应的物质是丁烷,所以答案是:丁烷;(2)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O, 所以答案是:2C4H10+13O2=8CO2+10H2O;(3)电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O
Cl2↑+H2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣;(4)电路中通过0.26NA的电子时,因为串联电池中转移电子数相等,所以消耗的氧气的体积(标况)为
Cl2↑+H2↑+2OH﹣;(4)电路中通过0.26NA的电子时,因为串联电池中转移电子数相等,所以消耗的氧气的体积(标况)为 ![]() ×22.4=1.456L,电解饱和食盐水生成的氯气的物质的量是
×22.4=1.456L,电解饱和食盐水生成的氯气的物质的量是 ![]() =0.13mol,生成氢氧化钠的物质的量为0.26mol,所以NaOH的物质的量浓度为
=0.13mol,生成氢氧化钠的物质的量为0.26mol,所以NaOH的物质的量浓度为![]() =1.3mol/L,所以答案是:1.456;0.13mol;1.3mol/L.
=1.3mol/L,所以答案是:1.456;0.13mol;1.3mol/L.


科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.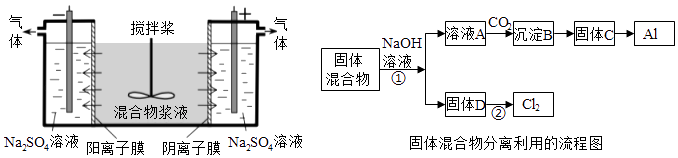
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
(1)Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .
(2)CO2和CH3OH分子中C原子的杂化形式分别为和 .
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.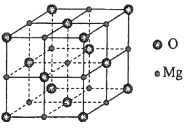
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量SO3分别加入到含有下列离子的溶液中,下列离子的物质的量不会减少的是( )
A. SO32- B. Ba2+ C. OH- D. Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mL Cl2 , 恰好将Fe2+完全氧化.下列说法正确的是( )
A.FexO溶于足量盐酸后只生成了FeCl3和H2O
B.标准状况下112 mL Cl2的物质的量是5 mol
C.x=0.8
D.通入Cl2后,发生反应的离子方程式:Fe2++Cl2=Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有10mL1molL﹣1 NH4Al(SO4)2溶液的烧杯中滴加1molL﹣1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下: 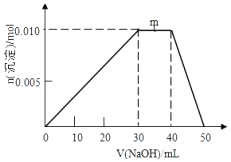
①写出m点反应的离子方程式: .
②若10mL1molL﹣1 NH4Al(SO4)2溶液中改加20mL1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某化学实验小组通过实验探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下: Cu2O溶于稀硫酸生成Cu和CuSO4 , Cu2O在空气中加热生成Cu O
假设1:红色粉末是Cu2O
假设2:红色粉末是 Fe2O3
假设3:红色粉末是 Fe2O3、Cu2O的混合物取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂
(1)若假设2成立,则实验现象是 .
(2)若滴加KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含Fe2O3 . 你认为这种说法合理吗?;简述你的理由(不需要写方程式)
(3)若固体粉末完全溶解无固体存在,滴加 KSCN试剂后溶液不变红色,则证明原固体粉末是 , 写出发生反应的离子方程式、 . 经实验分析,确定红色粉末是Fe2O3 和 Cu2O 的混合物
(4)实验小组欲用加热法测定 Cu2O 的质量分数.取 mg 固体粉末在空气中充分加热,待质量不再变化时,称其质量为n g(n>m),则混合物中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 氧化剂具有氧化性
B. 氧化剂发生氧化反应
C. 氧化剂发生反应后生成氧化产物
D. 氧化还原反应的任何一种反应物不是氧化剂就必定是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com