
 CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:| 浓度 物质 | CO | H2O | CO2 | H2 |
| 起始浓度/(mol·L-1) | 2.0 | x | 0 | 0 |
| 平衡浓度/(mol·L-1) | 0.4 | 6.4 | 1.6 | 1.6 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )| A.提高尾气净化效率的最佳途径是研制高效催化剂 |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
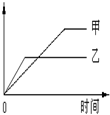
| | 反应 | 纵坐标 | 甲 | 乙 |
| A | 等质量钾、钠分别与足量水反应 | H 2质量 | 钠 | 钾 |
| B | 相同质量氨气,在同一容器中 2NH3  N2+3H2 ΔH >0 N2+3H2 ΔH >0 | 氨气的转化率 | 500℃ | 400℃ |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2,N2+3H2 2NH3 2NH3 | 氨气的浓度 | 活性一般的催化剂 | 活性高的催化剂 |
| D | 2molSO2与lmolO2,在相同温度下2SO2(g)+O2(g)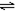 2SO3(g) 2SO3(g) | SO3物质的量 | 2个大气压 | 10个大气压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
| A.②④ | B.② | C.①② | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,| 温度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
 CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

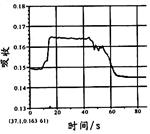 | 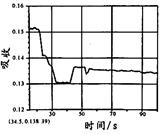 |  | 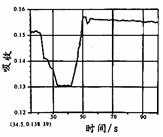 |
| A. | B. | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
B.对2HI H2+I2平衡体系增加压强使颜色变深 H2+I2平衡体系增加压强使颜色变深 |
| C.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
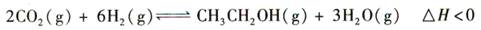
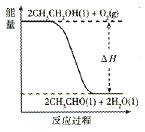
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com