
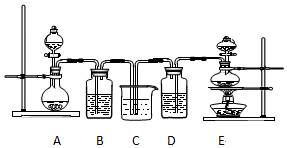

分析 要证明和比较SO2和氯水的漂白性,需制取二氧化硫和氯气,制二氧化硫用硫酸与亚硫酸钠,不用加热,制氯气用二氧化锰和浓盐酸并加热,则A装置制二氧化硫,E装置制氯气.
(1)实验室用二氧化锰与浓盐酸加热反应制备氯气;
(2)根据二氧化硫的漂白性是可逆的,而氯水的漂白性是不可逆的进行解答;
(3)二氧化硫和氯气都是有毒气体需要进行尾气处理,以免污染空气;
(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
②氯气和二氧化硫在水溶液中恰好发生氧化还原反应,转化成没有漂白性的盐酸和硫酸,所以品红溶液几乎不褪色;
③当通入的二氧化硫或者氯气一方有剩余时,又会使品红溶液褪色.
解答 解:(1)采用MnO2和浓盐酸(12mol/L)为原料制取Cl2.制取Cl2的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应,该生成的无色物质不很稳定,受热又能分解放出SO2,而恢复原来的红色,氯气使品红褪色是氧化性漂白,不可还原,无法恢复,
故答案为:溶液恢复红色;溶液仍无色;二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红;
(3)氯气和二氧化硫都有毒,不能直接排放到空气中,所以用氢氧化钠吸收过量的二氧化硫和氯气,防止污染空气,
故答案为:吸收多余的SO2和Cl2,防止污染环境;
(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
故答案为:通过观察气泡控制气体的流速;
②氯气和二氧化硫在水溶液中恰好完全反应,反应的离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
③当通入的二氧化硫或者氯气中一种气体过量,过量的氯气或者二氧化硫气体能够使品红褪色,
故答案为:控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1).
点评 本题主要考查了二氧化硫的制备以及其相关性质的综合实验,解题过程中,应围绕课本基本知识,如“二氧化硫使品红溶液褪色”、“二氧化硫与氯气反应生成氯化氢和硫酸”等基础知识,同时,对于实验的设计,尤其是多因素影响的实验,应考虑“控制变量法”,题目难度中等.


科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
A.v(O2)=0.01 mol·L-1·s-1 B.v(NO)=0.08 mol·L-1·s-1
C.v(H2O)=0.003 mol·L-1·s-1 D.v(NH3)=0.001 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 60% | D. | 70% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1L pH=13的氢氧化钡溶液所含OH- 数为0.2NA | |
| B. | 标准状况下,0.1molAl3+含有的核外电子数为0.3 NA | |
| C. | 常温下,44gCO2中含有2NA个碳氧双键 | |
| D. | 将1 molN2 和3mol H2 通入密闭容器中,一定条件下充分反应,转移电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com