
| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2=v3 | |
| D. | 中和热A=B=C |
分析 氨水为弱碱,同等pH值的氨水溶液与氢氧化钠溶液,氨水的浓度要比氢氧化钠大,据此解答即可.
解答 解:氨水为弱碱,同等pH值的氨水溶液与氢氧化钠溶液,氨水的浓度要比氢氧化钠大,
A、氨水浓度越小,电离程度越大,故A和B能中和同量的盐酸时,消耗A的体积>B的10倍,故A正确;
B、加入少量水稀释,氨水电离程度增大,但是碱性减弱,故氢氧根浓度减小,温度不变,故:$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不变,氢氧根浓度减小,故$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大,故B错误;
C、由于氨水是弱碱,故随着反应的进行继续电离出氢氧根,故v2<v3,故C错误;
D、中和热的定义为:稀的强酸与稀的强碱反应生成1mol水放出的热量,由于氨水是弱碱,故电离需要吸热,故反应热ABC不同,故D错误,故选A.
点评 本题主要考查的是弱碱的电离以及影响其电离的因素等,难度较大,注意分析溶液中各种离子的浓度变化是关键.


科目:高中化学 来源: 题型:解答题

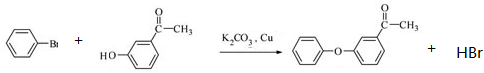 .
.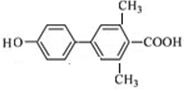 、
、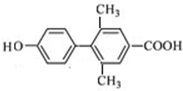 、
、 、
、 (其中一种).
(其中一种).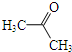 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物Cu2HgI4中,Cu元素的化合价为+2 | |
| B. | 由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-=CuI | |
| C. | 该反应的氧化剂CuI,氧化产物为Cu | |
| D. | 当有2molCuI参与反应时,转移电子为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2(HCl):饱和食盐水 | B. | H2(H2S、HCl、H2O):碱石灰 | ||
| C. | SO2(HCl):Na2SO3溶液 | D. | CO2(H2S):CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
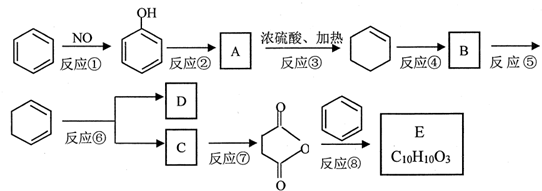
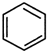 +(CH3CO)2O→
+(CH3CO)2O→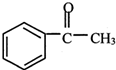 +CH3COOH
+CH3COOH ; B
; B
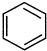 直接制取
直接制取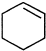 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.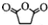 +
+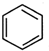 →
→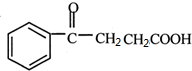 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子与原子之间 | B. | 分子与分子之间 | C. | 离子与离子之间 | D. | 离子与电子之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 也可发生类似反应①的反应,生成化合物Ⅳ:
也可发生类似反应①的反应,生成化合物Ⅳ: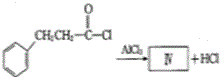
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液显酸性 | |
| B. | c(H+)+c(K+)=c(OH-)+c(Cl-)+c(HCO3-)+c(CO32-) | |
| C. | c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | c(K+)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com