
【题目】为了测定草酸晶体(H2C2O4xH2O)中的x值,进行如下实验
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL-1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2(C2O)4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
①实验中,不需要的仪器有(填序号)_______________
A、托盘天平(带砝码、镊子) B、滴定管 C、100mL的量筒
D、100mL的容量瓶 E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒
I、药匙 J、烧瓶
②实验中,标准液KMnO4溶液应装在_______式滴定管中,因为________________
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会_________(填偏大、偏小、无影响).
④在滴定过程中若用去amolL-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_____________molL-1,由此,x=_____________ .
⑤若滴定终点读数时俯视刻度,则计算的x值会_______(填偏大、偏小、无影响).
【答案】 CFJ 酸 高锰酸钾具有强氧化性 无影响 0.1aV ![]() 偏大
偏大
【解析】①为了配制准确浓度的草酸溶液,所需要的实验仪器主要有托盘天平(带砝码、镊子)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,
故需要的仪器有:ABDEGHI,还缺少的仪器有:胶头滴管、铁架台(带滴定管夹),但不需要100mL的量筒、漏斗、烧瓶,答案选CFJ;②高锰酸钾具有强氧化性,会腐蚀橡胶管,应装在酸式滴定管中;③滴定时为减小实验误差,应用少量蒸馏水将锥形瓶内壁冲洗,使草酸完全反应,所以用少量蒸馏水将锥形瓶内壁冲洗一下,对实验结果无影响;
④2KMnO4 ~5H2C2O4
2mol 5mol
aV×10-3mol 0.025L×cmol/L
解得:c=0.1aVmolL-1
H2C2O4xH2O~H2C2O4 ~xH2O
1mol 18xg
0.1aV×0.1 w-0.1aV×0.1×90
解得x=![]() -5;
-5;
⑤滴定终点时俯视滴定管刻度,会导致测量体积偏小,测定草酸质量偏小,则x值会偏大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 酸性氧化物 | 碱性氧化物 | |
A | Na2CO3 | H2SO4 | NaOH | CO2 | SO2 |
B | NaOH | HCl | NaCl | CO | Na2O |
C | NaOH | CH3COOH | CaF2 | SO2 | CO |
D | KOH | HNO3 | CaCO3 | SO3 | CaO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() I是常规核裂变产物之一,可以通过测定大气或水中的
I是常规核裂变产物之一,可以通过测定大气或水中的 ![]() I含量变化来检测核电站是否发生放射性物质泄漏.下列有关
I含量变化来检测核电站是否发生放射性物质泄漏.下列有关 ![]() I的叙述中错误的是( )
I的叙述中错误的是( )
A. ![]() I的原子核外电子数为53 B.
I的原子核外电子数为53 B. ![]() I与
I与 ![]() I互为同位素
I互为同位素
C. ![]() I的化学性质与
I的化学性质与 ![]() I相同 D.
I相同 D. ![]() I与
I与 ![]() I为同种核素
I为同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是
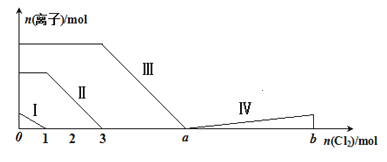
A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ![]() H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是

A. 电路中每流过2mol电子,电池内部释放316kJ热能
B. 每34gH2S参与反应,有2mol H+经质子膜进入正极区
C. 电极a为电池的负极
D. 电极b上发生的电极反应为:O2+4e![]() +4 H+=2H2O
+4 H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是



A. 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com