
【题目】下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
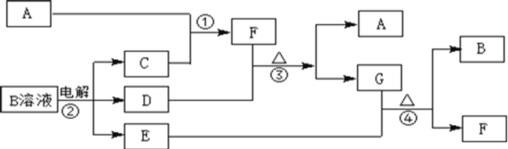
(1)写出化学式A_______,D_________,F_______;
(2)鉴定G中阳离子的实验方法和现象_____________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式_________、_______。
(4)常温下,电解B溶液制得pH = 12的烧碱溶液1000mL则反应中转移的电子数目为________。
【答案】N2 Cl2 NH3 取少量D的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色 2OH-+Cl2=ClO-+Cl-+H2O 8NH3+3Cl2=N2+6NH4Cl 0.01NA
【解析】
A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂,判断F为NH3;B电解生成CDE,可以初步推断是电解氯化钠溶液的产物为H2、Cl2、NaOH,所以C为H2,A为N2,D+F(NH3)=A(N2)+G,能发生反应的只能是D为Cl2,推断G为NH4Cl,G(NH4Cl)+E(NaOH)=B(NaCl)+F(NH3),符合转化关系;
(1)由以上分析可知A为N2,D为Cl2,F为NH3,故答案为:N2;Cl2;NH3;
(2)G为NH4Cl,阳离子为![]() ,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;故答案为:取少量G的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;故答案为:取少量G的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
(3)D单质和E溶液反应是氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,则离子反应为2OH-+Cl2=ClO-+Cl-+H2O,故答案为:2OH-+Cl2=ClO-+Cl-+H2O;
(4) B是NaCl,常温下,pH = 12的烧碱溶液1000mL,![]() ,电解NaCl溶液的化学方程式:
,电解NaCl溶液的化学方程式:![]() ,由转移电子数与产物氢氧化钠的关系式可知:
,由转移电子数与产物氢氧化钠的关系式可知: ,反应中转移的电子数目为0.01 NA;故答案为0.01 NA。
,反应中转移的电子数目为0.01 NA;故答案为0.01 NA。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】根据量子力学计算,氮化碳结构有五种,其中一种β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列有关氮化碳的说法不正确的是

A. 该晶体中的碳、氮原子核外都满足8电子稳定结构
B. 氮化碳中碳显+4价,氮显-3价
C. 每个碳原子与四个氮原子相连,每个氮原子和三个碳原子相连
D. 氮化碳的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+4OH-=Fe3O4↓+S4O
+O2+4OH-=Fe3O4↓+S4O![]() +2H2O。
+2H2O。
①参加反应的氧化剂与还原剂的物质的量之比为______。
②若有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为______mol。
③每生成1molFe3O4,反应转移的电子为______mol。
(2)往含Fe3+、H+、NO![]() 的混合液中加入少量SO
的混合液中加入少量SO![]() ,反应的离子方程式为______。
,反应的离子方程式为______。
(3)向CuSO4溶液中逐滴加入KI溶液至过量,观察到有沉淀(CuI)生成,且溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。写出此过程涉及的离子方程式______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为l.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)分别达到平衡。下列说法正确的是
CH3OH(g)分别达到平衡。下列说法正确的是
容器 | 温度(K) | 起始浓度(mol/L) | CH3OH平衡浓度(mol/L) | ||
H2 | CO | CH3OH | |||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | X |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应是吸热反应
B. X=0.16
C. 平衡时,容器②中H2的体积分数比容器①的大
D. 400K时若再向容器①中充入0.10molH2、0.10molCO和0.10molCH3OH,则平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是
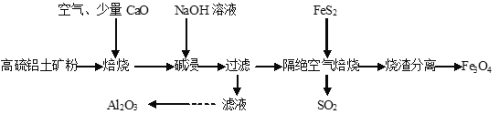
A.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B.向滤液中通入过量HCl气体、过滤、洗涤、灼烧沉淀可制得Al2O3
C.隔绝空气焙烧时理论上反应消耗的n(FeS2):n(Fe2O3)=1:5
D.烧渣分离可用磁选法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
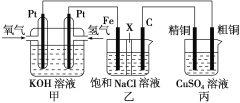
根据要求回答相关问题:
(1)通入氢气的电极为____(填“正极”或“负极”),负极的电极反应式为____________________________。
(2)石墨电极为____(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,____(填“铁极”或“石墨极”)区的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为______________________________________。
(4)写出上述例题中乙池电解的总反应方程式:_________________________。
(5)若上述例题甲池中消耗标准状况下的氢气11.2 L,则丙池中理论上应析出铜的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是 ( )
A.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:![]()
B.向沸水中滴加饱和氯化铁溶液得到红褐色液体:![]()
C.二氧化硫使酸性高锰酸钾溶液褪色:![]()
D.用铜做电极电解NaCl溶液: 2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
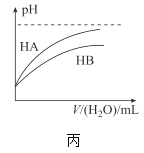
【题目】下列关于各图的叙述正确的是( )



A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,则
发生反应过程中的能量变化,则![]() 的燃烧热为
的燃烧热为![]()
B.乙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度的NaA溶液的pH小于同浓度NaB溶液的pH
D.丁表示![]() 溶液滴定
溶液滴定![]() 醋酸溶液得到的滴定曲线
醋酸溶液得到的滴定曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com