
����Ŀ����1��ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ��3Fe2++2S2O![]() +O2+4OH-=Fe3O4��+S4O
+O2+4OH-=Fe3O4��+S4O![]() +2H2O��
+2H2O��
�ٲμӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
������2molFe2+����������Fe2+��ԭ��O2�����ʵ���Ϊ______mol��
��ÿ����1molFe3O4����Ӧת�Ƶĵ���Ϊ______mol��
��2������Fe3+��H+��NO![]() �Ļ��Һ�м�������SO
�Ļ��Һ�м�������SO![]() ����Ӧ�����ӷ���ʽΪ______��
����Ӧ�����ӷ���ʽΪ______��
��3����CuSO4��Һ����μ���KI��Һ���������۲쵽�г���(CuI)���ɣ�����Һ��Ϊ��ɫ������Ӧ��Ļ�����в���ͨ��SO2���壬��Һ�����ɫ��д���˹����漰�����ӷ���ʽ______��______��
���𰸡�1:4 0.5 4 2H++2NO![]() +3SO
+3SO![]() =2NO��+ 3SO
=2NO��+ 3SO![]() +H2O 2Cu2++4I- =2CuI��+I2 I2+SO2+2 H2O =2 I-+ SO
+H2O 2Cu2++4I- =2CuI��+I2 I2+SO2+2 H2O =2 I-+ SO![]() +4 H+
+4 H+
��������
����Ԫ�صĻ��ϼ۱仯�����������ͻ�ԭ�������ݵ���ת���غ����������ԭ����ؼ��㣻�������ӵ������Ե�ǿ���ж����Ȳμӷ�Ӧ�����ӣ�����Ԫ�صĻ��ϼ۱仯���ɷ���������ԭ�IJ��ﲢ��ƽ��
(1)ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ��3Fe2++2S2O![]() +O2+4OH-=Fe3O4��+S4O
+O2+4OH-=Fe3O4��+S4O![]() +2H2O��
+2H2O��
�ٸ���Ԫ�صĻ��ϼ۱仯��֪���÷�Ӧ�е���Ԫ��������֮����+2���ߵ�+3����Ԫ��ȫ����+2���ߵ�+2.5�����������е���Ԫ��ȫ����0�۽��͵�-2��O2ֻ����������Fe2+��S2O![]() ������ԭ�������Բμӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1:4��
������ԭ�������Բμӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1:4��
��1molO2�ڷ�Ӧ�п��Եõ�4mole-������2molFe2+�������������仯�ϼ۱仯��֪��ʧȥ2mol���ӣ���Fe2+��ԭ��O2�����ʵ���Ϊ0.5mol��
�������Ϸ�����֪��ÿ����1molFe3O4������1molO2�μӷ�Ӧ����Ӧת�Ƶĵ���Ϊ4mol��
(2)����Fe3+��H+��NO![]() �Ļ��Һ�м�������SO
�Ļ��Һ�м�������SO![]() ������������������NO
������������������NO![]() ��������ǿ��Fe3+������ֻ��H+��NO
��������ǿ��Fe3+������ֻ��H+��NO![]() ��SO
��SO![]() ������Ӧ�����ӷ���ʽΪ2H++2NO
������Ӧ�����ӷ���ʽΪ2H++2NO![]() +3SO
+3SO![]() =2NO��+ 3SO
=2NO��+ 3SO![]() +H2O��
+H2O��
(3)��CuSO4��Һ����μ���KI��Һ���������۲쵽�г���(CuI)���ɣ�����Һ��Ϊ��ɫ��˵����I2���ɡ�����Ӧ��Ļ�����в���ͨ��SO2���壬��Һ�����ɫ��˵��I2�ֱ�SO2��ԭΪI-���˹����漰�����ӷ���ʽΪ2Cu2++4I-=2CuI��+I2��I2+SO2+2 H2O =2 I-+ SO![]() +4 H+��
+4 H+��


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����
A. l00g 9%��������ˮ��Һ����ԭ����Ϊ0.3 NA
B. ��״���£�2.24L F2ͨ����������ʳ��ˮ�п��û���0.1NA��Cl2
C. ��ҵ�ϳɰ�ÿ����NA��N��N����ͬʱ����6NA��N-H������Ӧ�ﵽƽ��
D. ������l LpH=7��1mol/LCH3COONH4��Һ��CH3COO-��NH4+��Ŀ��ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ�������26�λ��������˰����ӵ�����(Na = 6. 022214076��l023mol-1),����2019��5��20����ʽ��Ч������˵������ȷ����
A. ��״����11. 2 L��CH3Cl�к�����ԭ�ӵ���ĿΪ1. 5NA
B. lmol Na2O2�����к������������ӵ�����ĿΪ3NA
C. l00mL lmolL-1 NH4Cl��Һ�к��������ӵ���Ŀ����0.1 NA
D. 18gD2O��H2O�Ļ�����к��е�������Ϊ9NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����( )
A.Cu�����ϡ�����ڼ���ʱ�ķ�Ӧ��3Cu+2NO3��+8H+![]() 3Cu2++2NO��+4H2O
3Cu2++2NO��+4H2O
B.����������ˮ������ˮ��Cl2+H2O![]() 2H++Cl��+ClO��
2H++Cl��+ClO��
C.����FeCl3��Һ��Ӧ��2Fe+Fe3+�T3Fe2+
D.��Ca(ClO)2��Һ��ͨ������CO2��Ca2++CO2+H2O�TCaCO3��+2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ����Ũ���ᷴӦ�õ�����ͭ��Һ�� NO2��N2O4��NO �Ļ�����壬��Щ������ 4.48 L O2����״������Ϻ�ͨ��ˮ�У�����ǡ����ȫ��ˮ�����������ᡣ������������ͭ��Һ�м��� 400 mL NaOH��Һ����ʱ Cu2+ǡ�ó�����ȫ������ NaOH ��Һ��Ũ���ǣ� ��
A.2 mol/LB.4 mol/LC.6 mol/LD.0.8 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ������ͼ��ʾ������˵������ȷ����
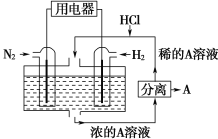
A. ͨ��N2�ĵ缫�����ĵ缫��ӦʽΪ��N2��6e����8H����2NH4+
B. ��Ӧ��������Һ��pH������Ҫ��������
C. �õ�����·������ͨ��H2�ĵ缫����ͨ��N2�ĵ缫
D. ͨ��H2�ĵ缫Ϊ������AΪNH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��ѧ��Դ�������õIJ��ֹ�����ͼ��ʾ������˵����ȷ���ǣ� ��
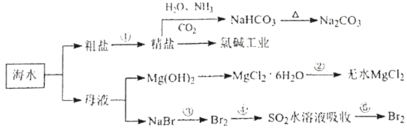
A.�ó����ʯ��ˮ�ɼ���NaHCO3��Na2CO3
B.�Ӻ�ˮ�еõ�������Ҫ��ͨ����������ʵ�ֵ�
C.�ڲ���ۣ��п�ͨ��Cl2ʹ�����ӱ���ԭΪBr2
D.�ڲ�����У�SO2ˮ��Һ����Br2����Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ѧ��ѧ�м��ֳ������ʵ�ת����ϵ(���ֲ�������ȥ)����֪��A��C��D�dz��������嵥�ʣ�F���弫������ˮ����Һ̬�����������
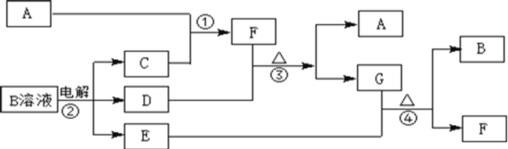
(1)д����ѧʽA_______��D_________��F_______��
(2)����G�������ӵ�ʵ�鷽��������_____________________________��
(3)D���ʺ�E��Һ��Ӧ������һ�ֳ�������������Ư������Ч�ɷ֣�д��D+E��Һ��Ӧ�����ӷ���ʽ�͢۵Ļ�ѧ����ʽ_________��_______��
(4)�����£����B��Һ�Ƶ�pH = 12���ռ���Һ1000mL��Ӧ��ת�Ƶĵ�����ĿΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϵ��NO�Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ(ͼ�е缫��Ϊʯī�缫)������˵���������

A. a �����ӵ�Դ�ĸ���
B. ������ӦΪNO+5e-+6H+=NH4++H2O
C. �ܷ�Ӧ����ʽΪ8NO+7H2O![]() 3NH4NO3+2HNO3
3NH4NO3+2HNO3
D. Ϊʹ������ȫ��ת��ΪNH4NO3���貹������A��A ��NH3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com