
【题目】常温下,如果取0.1molL﹣1 HA溶液与0.1molL﹣1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:(用离子方程式表示).
(2)混合溶液中由水电离出的c(OH﹣)(填“>”、“<”或“=”)0.1molL﹣1 NaOH溶液中由水电离出的 c(OH﹣).
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(OH﹣)﹣c(HA)=molL﹣1 .
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液NH4+按由大到小的顺序排列是(填序号). A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl.
【答案】
(1)A﹣+H2O?HA+OH﹣
(2)>
(3)10﹣8
(4)>;CADB
【解析】解:常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,则HA为弱酸,(1)A﹣水解导致NaA溶液呈碱性,水解方程式为A﹣+H2OHA+OH﹣ , 故答案为:A﹣+H2OHA+OH﹣;(2)混合溶液中水电离出的c(OH﹣)= ![]() mol/L=10﹣6mol/L、NaOH溶液中由水电离出的c(OH﹣)=c(H+)=
mol/L=10﹣6mol/L、NaOH溶液中由水电离出的c(OH﹣)=c(H+)= ![]() mol/L=10﹣13mol/L,所以混合溶液中由水电离出的c(OH﹣)>0.1molL﹣1 NaOH溶液中由水电离出的c(OH﹣),
mol/L=10﹣13mol/L,所以混合溶液中由水电离出的c(OH﹣)>0.1molL﹣1 NaOH溶液中由水电离出的c(OH﹣),
故答案为:(3)根据质子守恒得:c(HA)+c(H+)=c(OH﹣),则c(OH﹣)﹣c(HA)=c(H+)=10﹣8mol/L,
故答案为:10﹣8;(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,即HA电离程度大于碳酸,所以铵根离子水解程度小于弱酸根离子,溶液呈碱性,则pH>7;
A.NH4HSO4溶液中,氢离子抑制了铵根离子的水解,则硫酸氢铵溶液中的铵根离子浓度大于氯化铵;
B.NH4A溶液中A﹣促进了铵根离子的水解,则该溶液中铵根离子浓度小于氯化铵;
C.(NH4)2SO4的化学式中含有2个铵根离子,铵根离子水解程度较小,则其溶液中铵根离子浓度最大;
D.NH4Cl中铵根离子正常水解;
根据分析可知,浓度相等的四种盐溶液NH4+按由大到小的顺序排列是:CADB,
故答案为:>;CADB.
常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,(1)弱酸根离子水解导致NaA溶液呈碱性;(2)混合溶液中水电离出的c(OH﹣)= ![]() 、NaOH溶液中由水电离出的c(OH﹣)=c(H+);(3)溶液中存在质子守恒,根据质子守恒计算;(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,据此判断(NH4)2CO3溶液酸碱性;离子促进了铵根离子的水解,硫酸氢铵电离出的氢离子抑制了铵根离子水解,硫酸铵中铵根离子浓度最大,据此进行判断.
、NaOH溶液中由水电离出的c(OH﹣)=c(H+);(3)溶液中存在质子守恒,根据质子守恒计算;(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,据此判断(NH4)2CO3溶液酸碱性;离子促进了铵根离子的水解,硫酸氢铵电离出的氢离子抑制了铵根离子水解,硫酸铵中铵根离子浓度最大,据此进行判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( ) 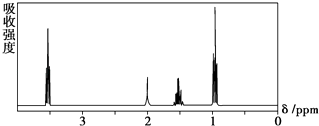
A.CH3CH2CH2CH3
B.(CH3)2CHCH3
C.CH3CH2CH2OH
D.CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题: 
(1)写出铜和稀硝酸反应的离子方程式: .
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体(填“能”或“不能”),请简述理由(用文字和化学方程式表示):
(3)若用实验装置乙进行实验,检查装置气密性的操作是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
A.z点对应的分散系很稳定
B.w、x、y三点中,水的电离程度最大的为y点
C.若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D.Ksp(CaCO3)=5×10-10mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的表述正确的是( )
A.次氯酸的电子式 ![]()
B.二氧化硅的分子式SiO2
C.硫原子的最外层电子排布式3s23p4
D.钠离子的结构示意图 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分MnO2 , 杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4H2O,反应的化学方程式为:MnO2+SO2═MnSO4 .
(1)质量为17.40g纯净MnO2最多能氧化L(标准状况)SO2 .
(2)已知:Ksp[Al(OH)3]=1×10﹣33 , Ksp[Fe(OH)3]=3×10﹣39 , pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10﹣6molL﹣1),需调节溶液pH范围为 .
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4H2O晶体,需控制的结晶温度范围为 . 
(4)准确称取0.1710gMnSO4H2O样品置于锥形瓶中加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+ , 用c(Fe2+)=0.050molL﹣1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL.MnSO4H2O样品的纯度 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com