
【题目】现有部分前36号元素的性质或原子结构信息如下表:
元素编号 | 元素的性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液a弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X |
|
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是______。
(2)S元素的常见化合价为_______,原因是_______。
(3)T元素的原子N电子层上的电子数为____________。
(4)X的轨道表示式违背了____________。用X单质、碱金属盐等可以制作焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:___________。
【答案】原子的2p轨道半充满,能量低,稳定 -1 F的电负性大,只能得电子 2 能量最低原则 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
【解析】
由题干信息推知R为N元素,S为F元素,T为Sc元素,X为Mg元素。
(1)R元素基态原子的轨道表示式可表示为![]() ;R为氮元素,氮原子2p轨道半充满,能量低,稳定,所以其第一电离能比同一周期相邻的碳元素、氧元素要大;
;R为氮元素,氮原子2p轨道半充满,能量低,稳定,所以其第一电离能比同一周期相邻的碳元素、氧元素要大;
(2)由题中信息可知S为氟元素,其电负性大,只能得电子,无正价,其常见化合价为-1
(3)基态T原子的核外电子排布式为![]() ,N电子层上只有2个电子
,N电子层上只有2个电子
(4)3s轨道电子未排满,X的轨道表示式违背了能量最低原则;燃放时,焰火发出五颜六色的光,电子从能量较高的轨道跃迁到能量较低的轨道时以光子的形式释放能量,所以可以做成烟火。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
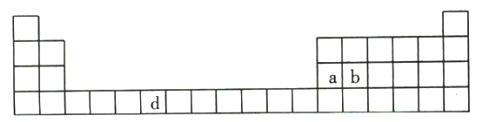
(1)请写出元素d的基态原子的电子排布式: _______________________________________。
(2)b的氧化物中b原子与氧原子之间的共价键类型是__________________________其中b原子的杂化方式是____________________________________________。
(3)a的单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。
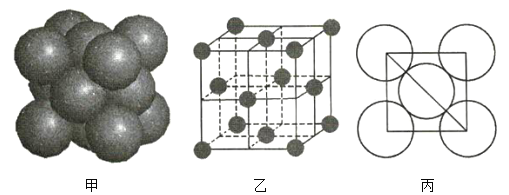
若已知a元素原子的半径为d,NA代表阿伏加德罗常数,a元素原子的摩尔质量为M,则1个晶胞中a原子的数目为____________________________,该晶体的密度为____________________________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH [pOH=-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是
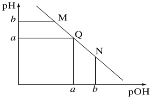
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(H+)=c(OH-),pH =7
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1。下列有关叙述中错误的是
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是原子序数依次增大的短周期元素。a、b、c、d、e、f是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,f是由W、Z、R元素形成的化合物。m为元素Z形成的单质,W与X能形成化合物XW4。上述物质的转化关系如图所示,下列说法正确的是( )
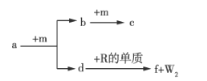
A.简单离子半径: R>Z
B.最高价氧化物对应水化物的酸性:X>Y
C.![]() 为离子化合物,含有离子键和共价键
为离子化合物,含有离子键和共价键
D.符合通式XnWn的化合物均能使溴的CCl4溶液因发生反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)又称碳酰氯,下列关于光气的叙述中正确的是
A.COCl2中含有2个σ键和1个π键
B.COCl2中C原子杂化轨道类型为sp2
C.COCl2为含极性键和非极性键的极性分子
D.COCl2分子的空间构型为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O+2H2O=4NaOH
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 都是非极性分子,
都是非极性分子,![]() 都是极性分子,由此推测ABn型分子是非极性分子的经验规律是( )
都是极性分子,由此推测ABn型分子是非极性分子的经验规律是( )
A.所有原子在同一平面上B.分子中每个键的键长应相等
C.A的相对原子质量小于BD.在ABn中A原子没有孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向20.00 mL 0.1 mol·L-1 NaOH溶液中滴加0.1 mol·L-1苯甲酸(C6H5COOH,弱酸)溶液,溶液的pH和pOH[pOH=-lgc(OH-)]关系如图所示。
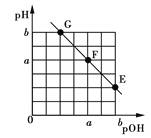
下列说法正确的是
A.在该温度下,0.1 mol·L-1 NaOH溶液的pH=2a+1
B.F点对应苯甲酸溶液体积V=20.00 mL
C.在G与F之间某点对应的溶液中水的电离程度最大
D.温度不变,加水稀释E点溶液,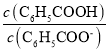 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com