
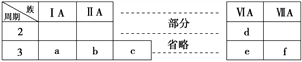
【题目】下表是元素周期表的一部分,表中字母分别表示一种元素。请回答下列问题:
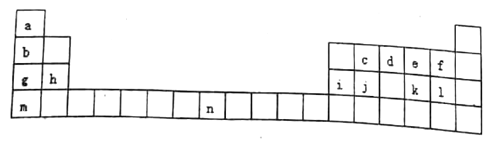
(1)a的一种核素核内有一个质子、一个中子。该核素的符号为______。
(2) 写出元素j在周期表中的位置____________。已知n原子的最外层有两个电子,画出其原子的结构示意图____________。
(3)a、d、f、g、m 五种元素的原子半径由小到大的顺序为________(用元素符号表示)。
(4) c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为______(用化学式表示)。
(5)上述元素形成的氢化物中最稳定的是_____(填写名称,下同),溶于水显碱性的是_____。
(6)e、k 两种元素得电子能力强的是_____ (用元素符号表示),用化学方程式证明结论_____ 。
(7)元素a、e 形成的原子个数1:1的化合物的分子式为_____,所含化学键的类型为______。
【答案】 ![]() 第三周期IVA族
第三周期IVA族 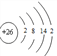 H<F<N<Na<K HClO4>HNO3>H2CO3>H4SiO4(H2SiO3) 氟化氢 氨气 O 2H2S+O2=2S+2H2O H2O2 共价键或极性键、非极性键
H<F<N<Na<K HClO4>HNO3>H2CO3>H4SiO4(H2SiO3) 氟化氢 氨气 O 2H2S+O2=2S+2H2O H2O2 共价键或极性键、非极性键
【解析】根据元素所在周期表中的位置可知a为H元素,b为Li元素,c为C元素,d为N元素,e为O元素,f为F元素,g为Na元素,h为Mg元素,i为Al元素,j为Si元素,k为S元素,l为Cl元素,m为K元素,n为Fe元素。(1)a为H元素,它的一种核素核内有一个质子、一个中子。该核素的符号为![]() ;(2)元素j为Si元素,在周期表中的位置第三周期IVA族。已知n原子的最外层有两个电子,其原子的结构示意图
;(2)元素j为Si元素,在周期表中的位置第三周期IVA族。已知n原子的最外层有两个电子,其原子的结构示意图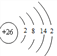 ;(3)同周期元素从左到右原子半径依次减小,同主族元素原子半径从上到下依次增大,故a、d、f、g、m五种元素的原子半径由小到大的顺序为H<F<N<Na<K;(4)元素非金属性越强,其最高价氧化物的水化物的酸性越强,则c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为HClO4>HNO3>H2CO3>H4SiO4(H2SiO3);(5)元素非金属性越强,氢化物越稳定的是,故氢化物最稳定的是氟化氢,氢化物溶于水显碱性的是氨气;(6)同主族从上而下非金属性减弱,元素得电子能力减弱,故e、k两种元素得电子能力强的是O,用化学方程式证明结论2H2S+O2=2S+2H2O;(7)元素a、e形成的原子个数1:1的化合物的分子式为H2O2,所含化学键的类型为共价键或极性键、非极性键。
;(3)同周期元素从左到右原子半径依次减小,同主族元素原子半径从上到下依次增大,故a、d、f、g、m五种元素的原子半径由小到大的顺序为H<F<N<Na<K;(4)元素非金属性越强,其最高价氧化物的水化物的酸性越强,则c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为HClO4>HNO3>H2CO3>H4SiO4(H2SiO3);(5)元素非金属性越强,氢化物越稳定的是,故氢化物最稳定的是氟化氢,氢化物溶于水显碱性的是氨气;(6)同主族从上而下非金属性减弱,元素得电子能力减弱,故e、k两种元素得电子能力强的是O,用化学方程式证明结论2H2S+O2=2S+2H2O;(7)元素a、e形成的原子个数1:1的化合物的分子式为H2O2,所含化学键的类型为共价键或极性键、非极性键。


科目:高中化学 来源: 题型:
【题目】右图是硫酸试剂标签上的部分内容,据此下列说法错误的是
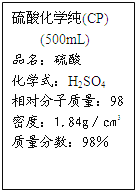
A. 该硫酸试剂的物质的量浓度为18.4mol/L
B. 该硫酸与等体积的水混合所得溶液的质量分数大于49%
C. 配制1.0mol /L的80mL 稀硫酸的实验过程中需要5mL量简、胶头滴管、100mL容量瓶等玻璃仪器
D. 一定条件下,将6.4gCu加入到足量该硫酸中可得到标准状况下的气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物理量与其相应的单位不匹配的是
A.摩尔质量:g /molB.气体摩尔体积:L/mol
C.物质的量:molD.物质的量浓度:L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学所学的常见物质且均含有同一中元素,它们之间的转化关系如图所示(反应条件及其它物质已经略去): ![]()
(1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则将B通入KMnO4溶液的现象为;体现B的(填“氧化性”“还原性”“漂白性”);请写出D的浓溶液与单质铜反应的化学方程式:;此反应中作氧化剂的D与参加反应的D的物质的量之比为;
(2)若A气体可使湿润的红色石蕊试纸变蓝,常温下D的浓溶液能使金属Fe、Al钝化,请写出实验室制备A的化学方程式:;请写出C→D的离子方程式 .
(3)若A是一种活泼金属,C是淡黄色固体,则C的名称为 , 试用化学方程式表示该物质与二氧化碳气体的反应;将C长期露置于空气中,最后将变成物质E,E的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2 , 含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下: 
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 , 植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5; ②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+ , 而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是;该反应的化学方程式为;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11 , Ksp(MgCO3)=2.6×10﹣5 , 已知离子浓度小于1.0×10﹣5molL﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法不正确的是( )
A. 元素b的单质不能与酸性氧化物发生化学反应
B. a、b、d、f四种元素的离子半径:f>d>a>b
C. 元素c的氧化物既能与酸反应又能与碱反应
D. a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的判断中,正确的观点是( )
A. 在熔融状态下能导电的物质
B. 在水溶液或熔融状态下能导电的物质
C. 在水溶液或熔融状态下能导电的化合物
D. 在水溶液和熔融状态下都能导电的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com