
【题目】化合物F是合成心脏病治疗药法西多曲的中间体,其合成路线流程图如图:
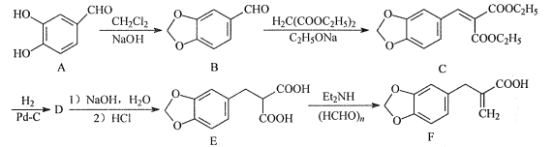
(1)C中的含氧官能团名称为___和___。
(2)A-B的反应类型为___。
(3)D的分子式为C15H18O6,写出D的结构简式:___。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与FeCl3溶液发生显色反应,不能发生银镜反应;
②苯环上有4个取代基,分子中只有4种不同化学环境的氢。
(5)请写出以H2C=CH2、H2C(COOC2H5)2、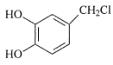 为原料制备
为原料制备 的合成路线流程图___(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
【答案】醚键 酯基 取代反应 


【解析】
根据题干信息,物质A、B、C的转化关系如下:
 A发生取代反应生成B,B发生取代反应生成C,C中含有官能团酯基,醚键和碳碳双键,能够与氢气在Pd-C的催化作用下发生加成反应生成D,且D的分子式为C15H18O6,则D的结构式为:
A发生取代反应生成B,B发生取代反应生成C,C中含有官能团酯基,醚键和碳碳双键,能够与氢气在Pd-C的催化作用下发生加成反应生成D,且D的分子式为C15H18O6,则D的结构式为: ,D物质再与氢氧化钠发生水解反应生成E,E再发生如下反应生成F:
,D物质再与氢氧化钠发生水解反应生成E,E再发生如下反应生成F:
 ,根据分析可回答问题;
,根据分析可回答问题;
(1)由上述过程可知,C的结构式为: ,C中的含氧官能团名称为酯基、醚键,故答案为醚键和酯基;
,C中的含氧官能团名称为酯基、醚键,故答案为醚键和酯基;
(2) 根据上述分析,A-B的反应类型为取代反应,故答案为:取代反应;
(3) C的碳碳双键与氢气在Pd-C的催化作用下,发生加成反应生成D,因此D的结构式为: ;
;
(4) B的分子式为C8H6O3,含有5个不饱和度,B能与FeCl3溶液发生显色反应,不能发生银镜反应,因此B含有酚羟基,不含有醛基,且B的苯环上有4个取代基,分子中只有4种不同化学环境的氢,苯环含3个不饱和度,剩下2个不饱和度为碳碳三键,则B的同分异构体可以是: ;
;
(5)
根据题干信息运用,可得到以H2C=CH2、H2C(COOC2H5)2、 为原料制备
为原料制备 的合成路线如下:
的合成路线如下:


科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了_____的作用力;二氧化硅熔化,粒子间克服了_____的作用力;碘的升华,粒子间克服了_____的作用力。三种晶体的熔点由高到低的顺序是_____。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为_____ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,五种物质的熔点由高到低的顺序是_____。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(5)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A_____;B_____;C_____;D_____。
A.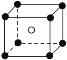 B.
B.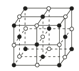 C.
C.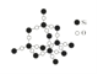 D.
D.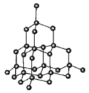
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中将含有较多Ca2+、Mg2+的水称为硬水。测定某水域的钙硬度、镁硬度(每升水中含Ca2+或Mg2+的质量,单位mg/L)的过程如下:
①取50.00mL水样,控制溶液的pH=10。以铬黑T为指示剂,用0.01000mol/LEDTA标准溶液滴定硬水中钙和镁的总含量至终点,消耗EDTA标准溶液30.00mL。
②另取50.00mL水样,加入10%NaOH溶液至pH=12.5,加入钙指示剂,用001000mol/LEDTA标准溶液滴定硬水中钙的含量至终点,消耗EDTA标准溶液20.00mL。
已知:Ca2+、Mg2+与EDTA反应的化学汁量比均为1:1。
(1)向硬水中加入石灰,可使Ca2+、Mg2+沉淀,以达到软化硬水的目的,写出Ca(OH)2和Ca(HCO3)2反应的化学方程式:___。
(2)“加入10%NaOH溶液至pH=12.5”的目的是___。
(3)计算该水样的钙硬度、镁硬度(写出计算过程)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,相对分子质量为392]。硫酸亚铁铵晶体比一般亚铁盐稳定,在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。
(2)酸浸净化后的废铁屑:将2gFe粉、10mL3mol·L-1的H2SO4溶液加入烧瓶中反应,用如图所示装置制备FeSO4溶液。保持温度70~80℃,适当添加水以补充被蒸发掉的水分,并控制溶液的pH,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。
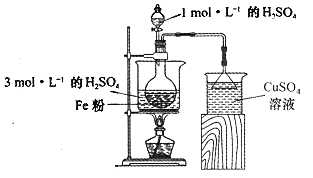
①反应过程中会产生少量H2S、PH3等气体,需使用封闭装置。写出用CuSO4溶液吸收H2S气体的化学反应方程式:____________________________
②反应过程中使用过量铁粉的目的是____________________________
(3)制备(NH4)2Fe(SO4)2·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。
A.通入过量Cl2:Fe2+、H+、NH4+、Clˉ、SO42ˉ
B.加入过量KSCN溶液:K+、NH4+、Fe3+、SO42ˉ、SCNˉ
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42ˉ、OHˉ
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42ˉ、Clˉ、ClOˉ、OHˉ
(4)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。重复上述操作2次实验结果如下:

该产品的纯度为____________________________(用含a、c的代数式表示)。
有同学提出,测定产品中SO42ˉ的含量也可测定产品的纯度,请补充完整实验方案:称取约0.4g样品,溶于70mL水,__________________________________________________,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中必须使用的试剂有:2mol·L-1的HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学为了验证明矾的化学组成,进行了如下实验:
(1)把明矾的水溶液分别加入两试管中,用焰色反应,透过蓝色钴玻璃观察火焰为紫色,说明含有________________;
(2)在其中一个试管中,加入过量氨水,产生大量白色沉淀,将沉淀分为两部分,分别加入过量的盐酸和氢氧化钠,沉淀均消夫,说明明矾溶液中含____________(离子符号),写出白色沉淀和氢氧化钠溶液反应的离子方程式________________________________________________;
(3)在另一个试管中,加入盐酸酸化过的氯化钡溶液,产生白色沉淀,说明明矾溶液中含____________________________ (离子符号);
(4)明矾水溶液的pH值________7,其原因是________________________________ (离子方程式);明矾可以用作净水剂,其原因是____________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸反应的实验改进装置如图所示,下列说法错误的是
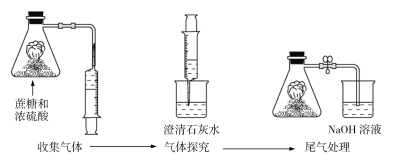
A.改进装置后,有毒气体被碱液吸收,实现了绿色环保
B.浓硫酸在实验过程中体现了脱水性和强氧化性
C.产生的气体能使澄清石灰水变浑浊,说明产生了CO2
D.该反应比较剧烈、危险,实验各物质的用量应按要求规范操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应方程式中不正确的是
A.铁在氯气中燃烧的反应:2Fe+3Cl2![]() 2FeCl3
2FeCl3
B.氨水与稀硫酸的反应:NH3·H2O+H+=H2O+![]()
C.氯气和氢氧化钠溶液的反应:Cl2+2OH-=Cl-+ClO-+H2O
D.铜和稀硝酸的反应:Cu+2H++NO2=Cu2++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理及对应的离子方程式均正确的是( )
A.室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++H2ONH3H2O+H+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣═2AlO2﹣+H2↑
C.Na2CO3溶液呈碱性的原因:![]()
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com