
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式__________________________________________,当该反应以表中数据反应完全时转移电子数为_______________NA
(2)V1 ______
(3)根据上表中的实验①、②数据,可以得到的结论是_____。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)
(5)该小组同学根据经验绘制了 n (Mn 2+ )随时间变化的趋势如图 1 所示,但有同学查阅已有的实验资料发现,该实验过程中 n (Mn 2+ ) 随时间变化的实际趋势如图 2 所示。

该小组同学根据图 2 所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①该小组同学提出的假设是_____。
②若该小组同学提出的假设成立,应观察到_________________________________现象。
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 0.00075 2.0 其他条件相同时,反应物浓度减小,反应速率减慢 ②、③ Mn2+对该反应有催化作用 褪色时间变短
【解析】
先根据得失电子守恒和原子守恒书写草酸和酸性高锰酸钾溶液反应的离子方程式,再根据探究反应速率的影响因素时采用“控制变量法”分析各小题。
(1). 根据得失电子守恒和原子守恒,H2C2O4和酸性高锰酸钾反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,反应的现象是溶液褪为无色,H2C2O4的浓度远大于KMnO4,KMnO4完全反应,高锰酸钾的物质的量为:0.05molL1×0.003L=0.00015mol,则完全反应时转移电子的物质的量为:0.00015mol×5=0.00075mol,数目为0.00075NA,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;0.00075;
(2). 利用实验②中的数据可知,溶液的总体积为10.0mL,所以实验①中V1=2.0mL,故答案为:2.0;
(3). 从表中数据可知改变的条件是草酸溶液的浓度,其他条件相同时,减小反应物的浓度,反应速率减慢,故答案为:其他条件相同时,反应物浓度减小,反应速率减慢;
(4). 探究温度对化学反应速率的影响时,应保持其他条件相同,则应选择②和③进行对比,故答案为:②、③;
(5). ①.对比图像,在其他条件相同时,再加入固体硫酸锰,所以该小组同学提出的假设是Mn2+对该反应有催化作用,故答案为:Mn2+对该反应有催化作用;
②. 若该小组同学提出的假设成立,则催化剂加快反应速率,可观察到的实验现象是溶液的褪色时间变短,故答案为:褪色时间变短。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图均为电化学装置,下列有关叙述正确的是( )
A.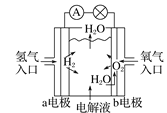 氢氧燃料电池示意图中,b电极发生氧化反应
氢氧燃料电池示意图中,b电极发生氧化反应
B. 电解氯化铜溶液装置中,铁棒上析出红色固体
电解氯化铜溶液装置中,铁棒上析出红色固体
C. 电镀实验装置中,若电镀前两电极质量相等,电镀完成后二者质量差为5.12 g,则电镀时待镀铁制品应与电源负极相连,外电路转移0.08 mol电子
电镀实验装置中,若电镀前两电极质量相等,电镀完成后二者质量差为5.12 g,则电镀时待镀铁制品应与电源负极相连,外电路转移0.08 mol电子
D. 交换膜法电解饱和NaCl溶液原理图中,离子交换膜应为阴离子交换膜
交换膜法电解饱和NaCl溶液原理图中,离子交换膜应为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断裂1mol化学键所需要的能量如下:
化学键 | N-N | O=O | N≡N | N-H |
键能kJ·mol-1 | a | 500 | 942 | 391 |
肼(N2H4)的有关反应能量变化如图所示,下列说法正确的是( )

A. 该图表示:1molN2H4与1molO2反应生成1molN2和2molH2O反应热△H=-2752kJ·mol-1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) △H=+2752kJ·mol-1
D. 当有2molH2O(g)生成时,放出534kJ·mol-1的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是
A. 气体的平均摩尔质量不变 B. BaO量减小
C. BaO2的转化率减小 D. 体积中密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究固体A的组成和性质,设计实验并完成如下转化。

已知:X由两种化合物组成,若将X通入品红溶液,溶液褪色。若将X通入足量双氧水中,X可全部被吸收且只得到一种强酸,再稀释到1000mL,测得溶液的PH=1。在溶液2中滴加KSCN溶液,溶液呈血红色。请回答:
(1)固体A的化学式______________。
(2)写出反应①的化学方程式____________。
(3)写出反应④中生成A的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A.常温常压下,2 g D2O 中含中子数为NA
B.1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4 NA
)分子中含有碳碳双键的个数为4 NA
C.0.5mol羟基中所含电子数为4.5NA
D.28g乙烯和丙烯(C3H6)的混合气体含有的碳原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中五点KW间的关系是__________________.
(2)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=2a,Va<Vb, 则a的取值范围为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com