
【题目】废定影液的主要成分为Na3[Ag(S2O3)2],用废定影液为原料制备AgNO3的实验流程如下:

(1) “沉淀”步骤中生成Ag2S沉淀,检验沉淀完全的操作是________。
(2) “反应”步骤中会生成淡黄色固体,该反应的化学方程式为________。
(3) “除杂”需调节溶液pH至6。测定溶液pH的操作是________。
(4) 已知:2AgNO3![]() 2Ag+2NO2↑+O2↑,2Cu(NO3)2
2Ag+2NO2↑+O2↑,2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑。AgNO3粗产品中常含有Cu(NO3)2,请设计由AgNO3粗产品获取纯净AgNO3的实验方案:______________________,蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得到纯净的AgNO3。(实验中须使用的试剂有稀硝酸、NaOH溶液、蒸馏水)
2CuO+4NO2↑+O2↑。AgNO3粗产品中常含有Cu(NO3)2,请设计由AgNO3粗产品获取纯净AgNO3的实验方案:______________________,蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得到纯净的AgNO3。(实验中须使用的试剂有稀硝酸、NaOH溶液、蒸馏水)
(5) 蒸发浓缩AgNO3溶液的装置如下图所示。使用真空泵的目的是________;判断蒸发浓缩完成的标志是____________________。
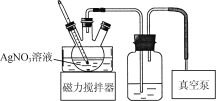
【答案】静置,向上层清液中继续滴加Na2S溶液,若不再有沉淀生成,则说明沉淀已经完全 Ag2S+4HNO3===2AgNO3+2NO2↑+S+2H2O 用洁净的玻璃棒蘸取反应液,滴在pH试纸上,与标准比色卡对照 将AgNO3粗产品加热并维持温度在200 ℃至恒重,同时用足量NaOH溶液吸收产生的气体,待固体残留物冷却后,加入蒸馏水,充分溶解、过滤、洗涤,并将洗涤液与滤液合并,再加入适量稀硝酸 使体系形成负压,有利于水分在较低温度下蒸发,同时可防止AgNO3分解 溶液表面有晶膜出现
【解析】
废定影液的主要成分为Na3[Ag(S2O3)2],用硫化钠沉淀,生成Ag2S沉淀,过滤得到滤渣,洗涤干净后加入浓硝酸溶解Ag2S得到硝酸银、硫单质与二氧化氮;用氢氧化钠除去过量的硝酸得到硝酸银溶液,蒸发浓缩、冷却结晶得到硝酸银晶体,据此分析作答。
(1)沉淀过程是Na3[Ag(S2O3)2]与Na2S反应制得Ag2S的反应,检验沉淀完全的操作是:静置,向上层清液中继续滴加Na2S溶液,若不再有沉淀生成,则说明沉淀已经完全;
(2)“反应”步骤中会生成淡黄色固体,根据元素守恒可知,该淡黄色沉淀为硫离子被氧化的产物硫单质,根据氧化还原反应规律可知其化学方程式为:Ag2S+4HNO3===2AgNO3+2NO2↑+S+2H2O;
(3)测定溶液pH的基本操作是:用洁净的玻璃棒蘸取反应液,滴在pH试纸上,与标准比色卡对照;
(4)根据给定的已知信息可知,硝酸铜的分解温度为200 ℃,硝酸银的分解温度在440 ℃,则可设计除去硝酸铜的方法为:将AgNO3粗产品加热并维持温度在200 ℃至恒重,同时用足量NaOH溶液吸收产生的气体,待固体残留物冷却后,加入蒸馏水,充分溶解、过滤、洗涤,并将洗涤液与滤液合并,再加入适量稀硝酸;
(5)考虑硝酸银易分解,而实验装置中真空泵可以形成负压,有利于水分在较低温度下蒸发,同时可防止AgNO3分解;蒸发浓缩过程中,若溶液表面有晶膜出现,则证明蒸发浓缩完成。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】尼洛替尼用于治疗白血病有显著疗效。有机化合物M(![]() )是合成尼洛替尼的中间体,其一种合成路线如图:
)是合成尼洛替尼的中间体,其一种合成路线如图:

已知:含有α—氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β—酮酸酯。如:
2CH3COOC2H5 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
回答下列问题:
(1)有机物A中含氧官能团的名称为___。
(2)M的分子中最多有___个碳原子在同一个平面上,M存在顺反异构现象,其反式异构体的结构简式是___。
(3)反应①的化学方程式为___;其反应类型为___。
(4)有机物![]() 有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。
有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。
(5)写出以乙醇、乙酸、 为原料合成
为原料合成 的合成路线(其它试剂任选)___。
的合成路线(其它试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加少量
溶液中滴加少量![]() 溶液,反应原理如图所示。关于该反应过程的说法正确的是
溶液,反应原理如图所示。关于该反应过程的说法正确的是

A.该反应过程中,![]() 是
是![]() 是
是![]() B.当有
B.当有![]() 生成时,转移
生成时,转移![]() 电子
电子
C.在![]() 分解过程中,溶液的
分解过程中,溶液的![]() 逐渐降低D.
逐渐降低D.![]() 的氧化性比
的氧化性比![]() 强,还原性比
强,还原性比![]() 弱
弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
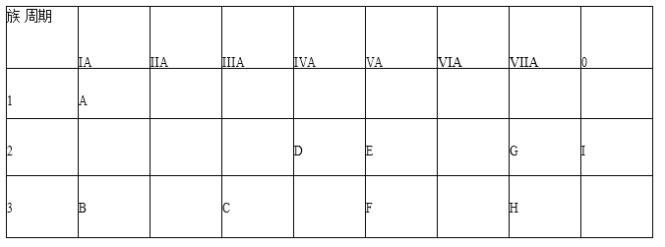
(1)表中元素,化学性质最不活泼的是_____,只有负价而无正价的是_____,氧化性最强的单质是____;
(2)最高价氧化物的水化物碱性最强的是_____,酸性最强的是_____,呈两性的是_____;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______可以验证该结论的实验是_。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锰(MnTiO3)纳米材料是一种多用途催化剂。工业上用红钛锰矿(主要成分有MnTiO3,还含有少量FeO、Fe2O3、SiO2等杂质)来制备MnTiO3,其工艺流程如图所示:
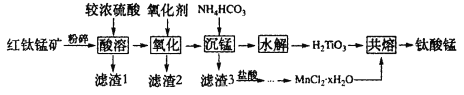
已知①红钛锰矿“酸溶”后Ti元素主要以TiO2+的形式存在;
②H2TiO3不溶于无机酸和碱,不溶于水;
③在空气中加热无水MnCl2分解放出HCl,生成Mn3O4。
回答下列问题:
(1)“粉碎”的目的是__。
(2)“酸溶”中发生的主要反应化学方程式为__。
(3)为了更好地把滤渣2分离出来,除搅拌外,还需要(填操作名称)___。
(4)“氧化”的氧化剂选用的是高锰酸钾,而不选择通常人们认可的绿色氧化剂“双氧水”,除了高锰酸钾氧化性强、反应快之外,还可能的原因是__(写出一条即可)。
(5)“沉锰”的条件一般控制在45℃以下的原因是__。
(6)TiO2+的水解率受温度和H+浓度的影响如图所示,TiO2+最适宜的水解条件是__。
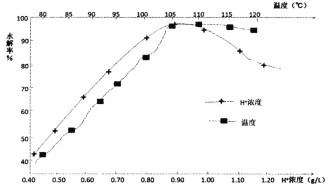
(7)测定所得MnCl2·xH2O晶体中结晶水的含量。取29.70g样品加热分解,热重曲线(TG)如图所示。
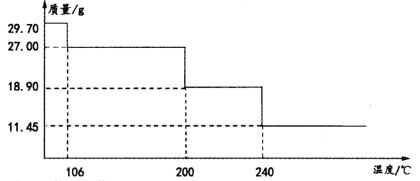
所得氯化锰晶体x的值是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用碳酸钙的分解产物与足量焦炭在高温电炉中生成电石。
(1)写出该反应的方程式:_____。
(2)电石的保存需严格防水,写出电石与水反应的化学方程式:_____。
(3)写出上述反应方程式中非极性分子的结构式:_____。
(4)写出电石的电子式_____。
(5)实验室用右图制取乙炔并验证乙炔与溴水发生了加成反应。

①实验中控制反应速率的措施有_____、_____。
②小试管中可能的现象是:溴水褪色、_____。
③溴水褪色_____(“能” “不能”)证明乙炔与溴发生了加成反应,若能,说明理由,若不能, 写出修改方案_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、COx的消除和再利用对改善生态环境、构建生态文明具有重要的意义。
Ⅰ.反应N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)△H2。
(1)已知CO的燃烧热为283.0kJ·mol-1,则△H2=___。
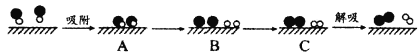
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 和
和![]() 分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
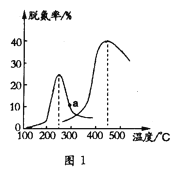
(3)另一研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内脱氮率(即NO的转化率)随温度的变化关系如图1所示。图中低于200℃,脱氮率随温度升高而变化不大的主要原因是___;a点(填“是”或“不是”)__对应温度下的平衡脱氮率,理由是__。
Ⅱ.向容积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)CH3OH(g)△H<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。
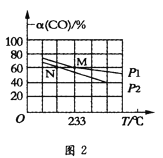
(4)反应速率:N点v正(CO)(填“大于”、“小于”或“等于”)__M点v逆(CO)。
(5)M点时,H2的转化率为__(计算结果精确到0.1%);用平衡分压代替平衡浓度计算该反应的平衡常数Kp=__(用含p1的最简表达式表达,分压=总压×物质的量分数)。
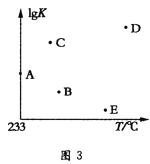
(6)不同温度下,该反应的平衡常数的对数值(lgK)如图3所示,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___(填字母符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。
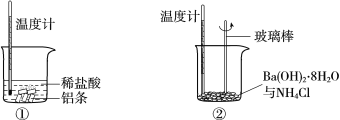
请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)①中反应的离子方程式是_________,该反应的还原剂是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列关于溶液中的量的关系判断正确的是
A. H+浓度:10c(H+)甲=c(H+)乙 B. OH-浓度:c(OH-)甲=10c(OH-)乙
C. 溶液浓度:c(甲)>10c(乙) D. 与等量NaOH反应耗酸体积:10V(甲)>V(乙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com