
【题目】鉴别四种溶液:NH4Cl、(NH4)2SO4、NaCl、Na2SO4 , 若只用一种化学试剂,则该试剂可以是 .
科目:高中化学 来源: 题型:
【题目】有5.1g镁铝合金投入500mL 2 mol/L盐酸溶液中,金属全部溶解后,再加入4 mol/L NaOH溶液,若要达到沉淀最大值,则加入NaOH溶液的体积应为( )
A. 560mL B. 425mL C. 500mL D. 250mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
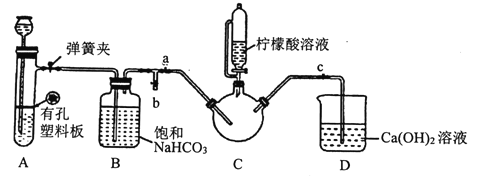
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 27g Al与NaOH完全反应,转移的电子数为0.1NA
B. 1L 1mol/L CaC12溶液中含有的Cl-离子数目为NA
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属粉末的混合物15.6g,投入足量的稀硫酸中充分反应,产生5.6 L标准状况时的氢气,此混合物不可能是( )
A. Fe和Zn B. Al和Zn C. Fe和Cu D. Mg和Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是________________________________。
(2)停止反应,待装置冷却后,取出反应后的混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中含有Fe3+的操作方法:______________________________。
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得的产物中不含+3价的铁,原因是(结合化学方程式说明)___________________。
(4)向上述滤液中加入NaOH 溶液后,观察到的现象为_______________________。沉淀由白色变为红褐色的原因是______________________________________(用化学方程式表示)
(5)为了得到白色的Fe(OH)2沉淀,并尽可能可能较长时间保持白色沉淀,该同学设计了如图所示的装置,请简述实验操作:______________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,分别向两杯100mL的水中逐渐加入少量NH4Cl和NaOH固体,溶液的pH变化如图所示。下列判断正确的是
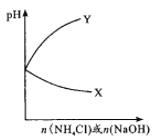
A. X代表NaOH,Y代表NH4Cl
B. pH变化相同时,n(NH4Cl)<n(NaOH)
C. 两份溶液的Kw均大于1.0×10-14
D. 若两杯溶液混合后呈中性,则加入的n(NH4Cl)和n(NaOH)不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是实验室常用的氧化剂,可用作水处理剂等。
(1)实验室用MnO2等为原料制取少量KMnO4的实验流程如下:

①“熔融”时,可用作坩埚材质的是__________ (填序号)。
a.氧化铝 b.陶瓷 c.铁 d.玻璃
②“K2MnO4歧化”的离子方程式为__________。
③“蒸发浓缩”时,温度需控制在80℃,适宜的加热方式是__________。
(2)高锰酸钾法测定水体COD(化学雷氧量)的实验步骤如下:
步骤1.准确移取100mL水样,置于250mL锥形瓶中。加入10mL1∶3的硫酸,再加入15.00mL0.0200mol·L-1KMnO4溶液(此时溶液仍呈紫红色)。
步骤2.用小火煮沸10min(水中还原性物质被MnO4-氧化,本身还原为Mn2+),取下锥形瓶趁热加10.00mL0.0500mol·L-1Na2C2O4溶液,充分振荡(此时溶液为无色)。
步骤3.趁热用0.0200 mol·L-1KMnO4溶液滴定至呈微红色,消耗KMnO4溶液4.500mL。通过计算确定该水样的化学需氧量(写出计算过程)。__________________[已知:COD是指在一定条件下,以氧化1L水样中还原性物质所消耗的氧化剂的量,通常换算为需要的O2的质量(mg),COD的单位mg·L-1。]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com