
【题目】甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )
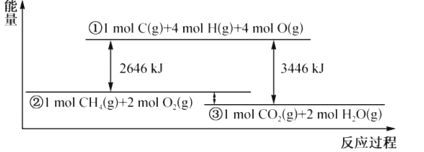
A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-800kJmol-1
C.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,有1mol O-H键生成
D.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1mol C-H键需吸收热量415kJ
【答案】D
【解析】
从图中可以提取以下信息:1molCH4(g)+2molO2(g)断裂所有共价键,需要吸收2646kJ的热量;1molC(g)+4molH(g)+4molO(g)结合成1molCO2(g)+2molH2O(g),能放出3446kJ的热量。
A.从图中看出,CH4(g)和O2的总能量大于CO2(g)和H2O(g)的能量总和,但CH4(g)的能量不一定大于CO2(g)和H2O(g)的能量总和,A不正确;
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-800kJmol-1,气态水变为液态会继续放热,B不正确;
C.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,则生成1molH2O,有2molO-H键生成,C不正确;
D.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量![]() kJ=415kJ,D正确;
kJ=415kJ,D正确;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。

根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__。比较X、Y、Z的简单离子半径大小为__<____<__(用离子符号表示);
(2)元素的非金属性Y__J(填“>”或“<”)。下列各项中,不能说明这一结论的有__(填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____(填化学式);酸根呈三角锥结构的酸是___(填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
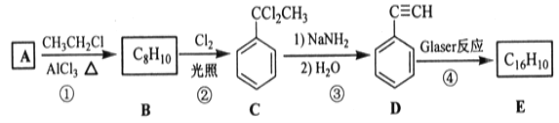
回答下列问题:
(1)B的结构简式为____,D的化学名称为___。
(2)①和③的反应类型分别为____、___。
(3)E的结构简式为___。用1 molE合成1,4-二苯基丁烷,理论上需要消耗氢气___mol。
(4)写出上述步骤④的化学方程式为____。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各离子能在指定溶液中一定大量共存的是( )
A.使甲基橙变红的溶液:Fe2+、NO3-、SO42-、Na+
B.加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.![]() 值为100的溶液:S2-、Na+、SO42-、SO32-
值为100的溶液:S2-、Na+、SO42-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
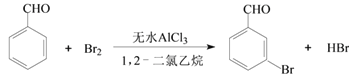
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
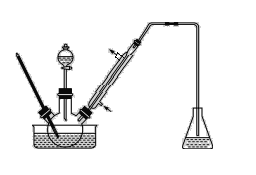
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往二元弱酸的钠盐Na2A溶液中通入HCl,溶液中-lg![]() 和-lgc(A2-)的关系如图所示。下列说法正确的是( )
和-lgc(A2-)的关系如图所示。下列说法正确的是( )
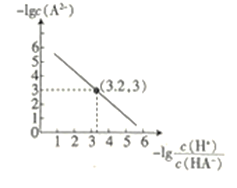
A.K(HA-)的数量级为10-7
B.通入HCl的过程中,水电离出的c(H+)不断增大
C.在Na2A溶液中:c(OH-)= c(H2A)+ c(HA-)+ c(H+)
D.当通入的HCl的物质的量与Na2A的物质的量相等时c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是存在于燃气中的一种有害气体,脱除H2S的方法有很多。
(1)国内有学者设计了“Cu2+一沉淀氧化”法脱除H2S。该法包括生成CuS沉淀,氧化CuS(Cu2++CuS+4Cl—=S+2CuCl2—)及空气氧化CuCl2—再生Cu2+。
①反应H2S(aq)+Cu2+(aq)CuS(s)+2H+(aq)的K=__________
②再生Cu2+反应的离子方程式为____________。
(2)采用生物脱硫技术时,H2S与碱反应转化为HS-,在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2。当33.6 m3(标准状况)某燃气(H2S的含量为0.2%)脱硫时,消耗NO3—的物质的量为___mol。
(3)已知下列热化学方程式:
Ⅰ.H2(g)+![]() O2(g)=H2O(l) H1=-285.8kJmol-1
O2(g)=H2O(l) H1=-285.8kJmol-1
Ⅱ. H2(g)+S(s)=H2S(g) H2=-20.6kJmol-1
Ⅲ.S(s)+O2(g)=SO2(g) H3=-296.8kJmol-1
则以Claus法脱除H2S的反应:2H2S(g)+SO2 (g)=3S(s)+2H2O(1) △H=________kJ/mol。
(4)101 kPa下,H2S分解:2H2S(g) 2H2(g)+S2(g)。保持压强不变,反应达到平衡时,气体的体积分数(φ)随温度的变化曲线如图:
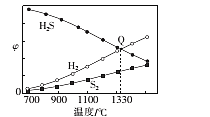
①在密闭容器中,关于反应2H2S(g) 2H2(g)+S2 (g)的说法正确的是____(填字母)。
A.Kp随温度的升高而增大
B.低压有利于提高HpS的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则v(正)<v(逆)
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点:H2S的平衡转化率为____;S2(g)的分压为____kPa;1330℃时,反应2H2S(g) 2H2(g)+S2(g)的Kp=_____(Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.1 mol CuOB.0.1 mol CuCO3
C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,其原子半径依X、Z、Y、W的顺序增大。已知Y的气态氢化物水溶液显碱性、Z是地壳中含量最高的元素,W的原子半径在同周期中最小(稀有气体除外)。下列说法正确的是( )
A.![]() 的酸性强于
的酸性强于![]() ,所以W的非金属性比Y强
,所以W的非金属性比Y强
B.X、Y分别与Z按原子个数比2∶1形成的化合物都是弱电解质
C.由Y和Z元素形成的氧化物最多可有5种
D.由X、Y、Z元素组成的化合物均为共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com