
ЁОЬтФПЁПXЁЂYЁЂZЁЂJЁЂQЁЂWЮЊЧАЫФжмЦкдЊЫиЃЌдзгађЪ§вРДЮдіДѓЁЃдЊЫиYдкЕиПЧжаКЌСПзюИпЃЌWЕФвЛжжГЃМћИпМлбѕЛЏЮяЪЧКьзиЩЋЗлФЉЃЌГЃгУгкгЭЦсЁЂЭПСЯЁЂгЭФЋЕФКьЩЋШОСЯЃЌ25ЁцXЁЂZЁЂJЁЂQЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяШмвК(ХЈЖШОљЮЊ0ЃЎ01molЁЄL-1)ЕФpHгыдзгађЪ§ЕФЙиЯЕШчЭМЫљЪОЁЃ

ИљОнЩЯЪіаХЯЂНјааХаЖЯЃЌВЂЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉWдкжмЦкБэжаЕФЮЛжУ__ЁЃБШНЯXЁЂYЁЂZЕФМђЕЅРызгАыОЖДѓаЁЮЊ__ЃМ____ЃМ__(гУРызгЗћКХБэЪО)ЃЛ
ЃЈ2ЃЉдЊЫиЕФЗЧН№ЪєадY__J(ЬюЁАЃОЁБЛђЁАЃМЁБ)ЁЃЯТСаИїЯюжаЃЌВЛФмЫЕУїетвЛНсТлЕФга__(ЬюађКХ)ЁЃ
AЃЎJЕФЧтЛЏЮяЕФЫЎШмвКЗХжУдкПеЦјжаЛсБфЛызЧ
BЃЎYгыJжЎМфаЮГЩЕФЛЏКЯЮяжадЊЫиЕФЛЏКЯМлЁЃ
CЃЎYКЭJЕФЕЅжЪЕФзДЬЌ
DЃЎYКЭJдкжмЦкБэжаЕФЮЛжУ
ЃЈ3ЃЉXЁЂJЁЂQетаЉдЊЫиаЮГЩЕФКЌбѕЫсжаЃЌЗжзгЕФжааФдзгЕФМлВуЕчзгЖдЪ§ЮЊ3ЕФЫсЪЧ_____(ЬюЛЏбЇЪН)ЃЛЫсИљГЪШ§НЧзЖНсЙЙЕФЫсЪЧ___(ЬюЛЏбЇЪН)ЁЃ
ЃЈ4ЃЉYКЭQаЮГЩЕФЛЏКЯЮяQ2YЕФСЂЬхЙЙаЭЮЊ__ЃЌQЕФЕЅжЪгыЪЊШѓЕФNa2CO3ЗДгІПЩжЦБИQ2YЃЌЦфЛЏбЇЗНГЬЪНЮЊ___ЁЃ
ЁОД№АИЁПЕкЫФжмЦкЂјзх Na+ O2- N3- > C HNO2ЁЂHNO3 H2SO3ЁЂHClO3 VаЮ 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(Лђ2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)
ЁОНтЮіЁП
XЁЂYЁЂZЁЂJЁЂQЁЂWЮЊЧАЫФжмЦкдЊЫиЃЌдзгађЪ§вРДЮдіДѓЁЃдЊЫиYдкЕиПЧжаКЌСПзюИпЃЌYЮЊбѕдЊЫиЃЌWЕФвЛжжГЃМћИпМлбѕЛЏЮяЪЧКьзиЩЋЗлФЉЃЌГЃгУгкгЭЦсЁЂЭПСЯЁЂгЭФЋЕФКьЩЋШОСЯЃЌWЮЊЬњдЊЫиЃЌГЃЮТЯТЃЌИљОнЭМБэ25ЁцXЁЂZЁЂJЁЂQЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяШмвК(ХЈЖШОљЮЊ0ЃЎ01molЁЄL-1)ЕФpHгыдзгађЪ§ЕФЙиЯЕШчЭМЫљЪОЃЌзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяШмвКХЈЖШОљЮЊ0.01molL-1ЃЌZЕФpHЮЊ12ЃЌЮЊвЛдЊЧПМюЃЌдђZЪЧNaдЊЫиЃЌXЁЂQЕФpHОљЮЊ2ЃЌЮЊвЛдЊЧПЫсЃЌдђXЮЊNдЊЫиЁЂQЮЊClдЊЫиЃЛJЕФpHаЁгк2ЃЌдђJЕФЮЊЖўдЊЧПЫсЃЌЙЪJЮЊSдЊЫиЃЎдђXЮЊNдЊЫиЁЂY ЮЊOдЊЫиЁЂZЪЧNaдЊЫиЁЂJЮЊSдЊЫиЁЂQЮЊClдЊЫиЁЂWЮЊFeЃЌ
ЃЈ1ЃЉИљОндЊЫижмЦкТЩНтЬтЃЌКЫЭтЕчзгХХВМЯрЭЌЕФРызгЃЌКЫЕчКЩЪ§дНДѓЃЌЖдКЫЭтЕчзгЕФЮќв§ФмСІдНЧПЃЌАыОЖдМаЁЃЛ
ЃЈ2ЃЉБШНЯЗЧН№ЪєадЪБЃЌвЊПДдкжмЦкБэЕФЮЛжУЃЌЗЧН№ЪєадПЩвдИљОнЕЅжЪбѕЛЏадЕФЧПШѕЃЌзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФЫсадЧПШѕЃЌЦјЬЌЧтЛЏЮяЕФЮШЖЈадЕШХаЖЯЃЛ
ЃЈ3ЃЉXЁЂJЁЂQетаЉдЊЫиаЮГЩЕФКЌбѕЫсжагаHNO2ЁЂHNO3ЁЂH2SO3ЁЂ H2SO4ЁЂHClOЁЂHClO3ЁЂ HClO4ЕШЁЃМЦЫуГіжааФдзгЕФМлВуЕчзгЖдЪ§ЃЌШЗЖЈЗжзгЕФСЂЬхЙЙаЭЃЛ
ЃЈ4ЃЉЛЏКЯЮяD2AЮЊCl2OЃЌМЦЫуOдзгЙТЕчзгЖдЪ§ЁЂМлВуЕчзгЖдЪ§ЃЌМлВуЕчзгЖдЪ§=ІФМќЪ§ФП+ЙТЕчзгЖдЪ§ЃЌНјЖјШЗЖЈПеМфЙЙаЭЃЛТШЦјгыЪЊШѓЕФNa2CO3ЗДгІЕУЕНCl2OЃЌгЩЕчзгзЊвЦЪиКуПЩжЊЃЌЯШЕУЕНHClЩњГЩЃЌHClдйгыЬМЫсФЦЗДгІЁЃ
XЁЂYЁЂZЁЂJЁЂQЁЂWЮЊЧАЫФжмЦкдЊЫиЃЌдзгађЪ§вРДЮдіДѓЁЃдЊЫиYдкЕиПЧжаКЌСПзюИпЃЌYЮЊбѕдЊЫиЃЌWЕФвЛжжГЃМћИпМлбѕЛЏЮяЪЧКьзиЩЋЗлФЉЃЌГЃгУгкгЭЦсЁЂЭПСЯЁЂгЭФЋЕФКьЩЋШОСЯЃЌWЮЊЬњдЊЫиЃЌГЃЮТЯТЃЌИљОнЭМБэ25ЁцXЁЂZЁЂJЁЂQЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяШмвК(ХЈЖШОљЮЊ0ЃЎ01molЁЄL-1)ЕФpHгыдзгађЪ§ЕФЙиЯЕШчЭМЫљЪОЃЌзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяШмвКХЈЖШОљЮЊ0.01molL-1ЃЌZЕФpHЮЊ12ЃЌЮЊвЛдЊЧПМюЃЌдђZЪЧNaдЊЫиЃЌXЁЂQЕФpHОљЮЊ2ЃЌЮЊвЛдЊЧПЫсЃЌдђXЮЊNдЊЫиЁЂQЮЊClдЊЫиЃЛJЕФpHаЁгк2ЃЌдђJЕФЮЊЖўдЊЧПЫсЃЌЙЪJЮЊSдЊЫиЃЎдђXЮЊNдЊЫиЁЂY ЮЊOдЊЫиЁЂZЪЧNaдЊЫиЁЂJЮЊSдЊЫиЁЂQЮЊClдЊЫиЁЂWЮЊFeдЊЫиЃЌ
ЃЈ1ЃЉWЪЧЬњдЊЫиЃЌWдкжмЦкБэжаЕФЮЛжУЕкЫФжмЦкЂјзх ЃЌNa+ ЃЌO2- ЃЌN3-ЕФКЫЭтЕчзгХХВМЯрЭЌЃЌКЫЕчКЩЪ§дНДѓЕФдЊЫиАыОЖдНаЁЃЌЙЪNa+ ЃМO2- ЃМN3-ЃЌ
Д№АИЮЊЃКNa+ ЃЌO2- ЃЌN3-ЃЛ
ЃЈ2ЃЉOКЭSЮЛгкЭЌжїзхдЊЫиЃЌЭЌжїзхДгЩЯЕНЯТЃЌЗЧН№ЪєадМѕШѕЃЌЙЪO>SЃЌ
AЃЎJЕФЧтЛЏЮяЕФЫЎШмвКЗХжУдкПеЦјжаЛсБфЛызЧЃЌСђЛЏЧтБЛПеЦјбѕЛЏГЩСђЕЅжЪЃЌПЩвджЄУїбѕЦјЕФбѕЛЏадДѓгкСђЃЌЙЪAе§ШЗЃЛ
BЃЎYгыJжЎМфаЮГЩЕФЛЏКЯЮяжадЊЫиЕФЛЏКЯМлЃЌЖўбѕЛЏСђжаСђЯде§ЫФМлЃЌбѕЯдИКЖўМлЃЌПЩжЄУїбѕЕФЗЧН№ЪєадЧПЃЌЙЪBе§ШЗЃЛ
CЃЎYКЭJЕФЕЅжЪЕФзДЬЌВЛФмШЗЖЈН№ЪєадКЭЗЧН№ЪєадЃЌЙЪCДэЮѓЃЛ
DЃЎYКЭJдкжмЦкБэжаЕФЮЛжУЃЌПЩжЊбѕдкСђЕФЩЯвЛжмЦкЃЌЫќУЧЮЛгкЭЌвЛжїзхЃЌЭЌжїзхдЊЫиДгЩЯЕНЯТЃЌАыОЖдіДѓЃЌЪЇЕчзгФмСІдіЧПЃЌЕУЕчзгФмСІМѕШѕЃЌЗЧН№ЪєадМѕШѕЃЌН№ЪєаддіЧПЃЌПЩвдЕУГіНсТлЃЌЙЪDе§ШЗЃЛ
ЙЪД№АИбЁCЃЛ
ЃЈ3ЃЉXЁЂJЁЂQетаЉдЊЫиаЮГЩЕФКЌбѕЫсжаЃЌЗжзгЕФжааФдзгЕФМлВуЕчзгЖдЪ§МлВуЕчзгЖдЪ§=ІФМќЪ§ФП+ЙТЕчзгЖдЪ§ЃЌ
етаЉдЊЫиФмЙЛаЮГЩКЌбѕЫсЕФЮЊNЁЂSЁЂClдЊЫиЃЌNЁЂSЁЂClетаЉдЊЫиаЮГЩЕФКЌбѕЫсжагаHNO2ЁЂHNO3ЁЂH2SO3ЁЂH2SO4ЁЂHClOЁЂHClO3ЁЂHClO4ЕШЁЃ
NO2жаNдзгМлВуЕчзгЖдЪ§ЪЧ2+![]() =3ЃЌКЌ1ЖдЙТЕчзгЖдЃЌЫљвдЮЊVаЮНсЙЙЃЌ
=3ЃЌКЌ1ЖдЙТЕчзгЖдЃЌЫљвдЮЊVаЮНсЙЙЃЌ
NO3жаNдзгМлВуЕчзгЖдЪ§ЪЧ3+![]() =3ЃЌВЛКЌЙТЕчзгЖдЃЌЫљвдЮЊЦНУцШ§НЧаЮЃЌ
=3ЃЌВЛКЌЙТЕчзгЖдЃЌЫљвдЮЊЦНУцШ§НЧаЮЃЌ
SO32жаSдзгМлВуЕчзгЖдЪ§ЪЧ3+![]() =4ЃЌКЌ1ЖдЙТЕчзгЖдЃЌЫљвдЮЊШ§НЧзЖаЮЃЌ
=4ЃЌКЌ1ЖдЙТЕчзгЖдЃЌЫљвдЮЊШ§НЧзЖаЮЃЌ
SO42жаSдзгМлВуЕчзгЖдЪ§ЪЧ4+![]() =4ЃЌВЛКЌЙТЕчзгЖдЃЌЫљвдЮЊе§ЫФУцЬхЃЌ
=4ЃЌВЛКЌЙТЕчзгЖдЃЌЫљвдЮЊе§ЫФУцЬхЃЌ
ClO3-жаClдзгМлВуЕчзгЖдЪ§ЪЧ=3+![]() =4ЃЌКЌ1ЖдЙТЕчзгЖдЃЌЫљвдЮЊШ§НЧзЖаЮЃЌ
=4ЃЌКЌ1ЖдЙТЕчзгЖдЃЌЫљвдЮЊШ§НЧзЖаЮЃЌ
дђЗжзгЕФжааФдзгЕФМлВуЕчзгЖдЪ§ЮЊ3ЕФЫсЪЧHNO2ЁЂHNO3ЃЛЫсИљГЪШ§НЧзЖНсЙЙЕФЫсЪЧH2SO3ЁЂHClO3ЃЛ
ЙЪД№АИЮЊЃКHNO2ЁЂHNO3ЃЛH2SO3ЁЂHClO3ЃЛ
ЃЈ4ЃЉЛЏКЯЮяD2AЮЊCl2OЃЌOЮЊжааФдзгЃЌаЮГЩ2ИіІвМќЃЌЙТЕчзгЖдЪ§ЮЊ![]() =2ЃЌдђжааФдзгЕФМлВуЕчзгЖдЪ§ЮЊ4ЃЌСЂЬхЙЙаЭЮЊVаЮЃЌТШЦјгыЪЊШѓЕФNa2CO3ЗДгІЕУЕНCl2OЃЌгЩЕчзгзЊвЦЪиКуПЩжЊЃЌЯШЕУЕНHClЩњГЩЃЌHClдйгыЬМЫсФЦЗДгІЃЌЗДгІЕФЗНГЬЪНЮЊЃК2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(Лђ2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)ЃЌ
=2ЃЌдђжааФдзгЕФМлВуЕчзгЖдЪ§ЮЊ4ЃЌСЂЬхЙЙаЭЮЊVаЮЃЌТШЦјгыЪЊШѓЕФNa2CO3ЗДгІЕУЕНCl2OЃЌгЩЕчзгзЊвЦЪиКуПЩжЊЃЌЯШЕУЕНHClЩњГЩЃЌHClдйгыЬМЫсФЦЗДгІЃЌЗДгІЕФЗНГЬЪНЮЊЃК2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(Лђ2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)ЃЌ
ЙЪД№АИЮЊЃКVаЮЃЛ2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(Лђ2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжаЙњПЦбЇМвгУеКФЋжЪщаДКѓЕФжНеХзїЮЊПеЦјЕчМЋЃЌЩшМЦВЂзщзАСЫЧсаЭЁЂШсадЁЂФмелЕўЕФПЩГфЕчяЎПеЦјЕчГиШчЭММзЃЌЕчГиЕФЙЄзїдРэШчЭМввЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ

A. ЗХЕчЪБЃЌжНеХжаЕФЯЫЮЌЫизїЮЊяЎЕчГиЕФИКМЋ
B. ГфЕчЪБЃЌШєбєМЋЗХГі1molO2ЃЌдђга4mol eЃЛиЕНЕчдДе§МЋ
C. ПЊЙиKБеКЯИјяЎЕчГиГфЕчЃЌXЖдгІГфЕчЕчМЋЩЯЕФЗДгІЮЊLi++eЃ=Li
D. ЗХЕчЪБЃЌLi+гЩе§МЋОЙ§гаЛњЕчНтжЪШмвКвЦЯђИКМЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ( )
A. зюЭтВуЖМжЛга2ИіЕчзгЕФXЁЂYдзгЃЌЛЏбЇаджЪвЛЖЈЯрЫЦ
B. дкЫљгаЕФдЊЫижаЃЌЗњЕФЕчИКадзюДѓ
C. ЧАЫФжмЦкдЊЫижаЃЌЛљЬЌдзгжаЮДГЩЖдЕчзггыЦфЫљдкжмЦкЪ§ЯрЭЌЕФдЊЫига4жж
D. ДЮТШЫсЗжзгЕФЕчзгЪНЃК![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжїзхдЊЫиЬМЁЂбѕЁЂЕЊЁЂЗњЁЂСзЁЂЮјМАИБзхдЊЫиФјЁЂЭдЊЫидкЛЏбЇжагаКмживЊЕФЕиЮЛЃЌЛиД№ЯТСаЮЪЬтЃК
(1)дкЛљЬЌ14Cдзгжа,КЫЭтДцдк___Ждзда§ЯрЗДЕФЕчзгЃЌЛљЬЌЕЊдзгЕФМлВуЕчзгХХВМЭМЮЊ____ЁЃ
(2)НЋF2ЭЈШыЯЁNaOHШмвКжаПЩЩњГЩOF2,OF2ЗжзгЙЙаЭЮЊ__ЦфжабѕдзгЕФдгЛЏЗНЪНЮЊ_______ЁЃ
(3)CuSO4ШмвКФмгУзїP4жаЖОЕФНтЖОМС,ЗДгІПЩЩњГЩPЕФзюИпМлКЌбѕЫсКЭЭ,ИУЗДгІЕФЛЏбЇЗНГЬЪНЪЧ_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ15ЗжЃЉжмЦкБэЧАЫФжмЦкЕФдЊЫиXЁЂYЁЂZЁЂTЁЂWЃЌдзгађЪ§вРДЮдіДѓЁЃXЕФКЫЭтЕчзгзмЪ§гыЦфжмЦкЪ§ЯрЭЌЃЌYЛљЬЌдзгЕФpЕчзгЪ§БШsЕчзгЪ§Щй1ИіЃЌZЛљЬЌдзгЕФМлЕчзгВужага2ИіЮДГЩЖдЕчзгЃЌTгыZЭЌжїзхЃЌWЛљЬЌдзгЕФMВуШЋГфТњЃЌNВужЛгавЛИіЕчзгЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉYЁЂZЁЂTжаЕквЛЕчРыФмзюДѓЕФЪЧ ЃЈЬюдЊЫиЗћКХЃЌЯТЭЌЃЉЃЌдзгАыОЖзюаЁЕФЪЧ ЁЃ
ЃЈ2ЃЉTЕФдзгНсЙЙЪОвтЭМЮЊ ЃЌWЛљЬЌдзгЕФЕчзгХХВМЪНЮЊ ЁЃ
ЃЈ3ЃЉXКЭЩЯЪіЦфЫћдЊЫижаЕФвЛжжаЮГЩЕФЛЏКЯЮяжаЃЌЗжзгГЪШ§НЧзЖаЮЕФЪЧ ЃЈЬюЛЏбЇЪНЃЉЃЛЗжзгжаМШКЌгаМЋадЙВМлМќЃЌгжКЌгаЗЧМЋадЙВМлМќЕФЛЏКЯЮяЪЧ ЃЈЬюЛЏбЇЪНЃЌаДвЛжжЃЉЁЃ
ЃЈ4ЃЉTгыZаЮГЩЕФЛЏКЯЮяжаЃЌЪєгкЗЧМЋадЗжзгЕФЪЧ ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ5ЃЉет5жждЊЫиаЮГЩЕФвЛжжвѕбєРызгИіЪ§БШЮЊ1:1аЭЕФХфКЯЮяжаЃЌвѕРызгГЪЫФУцЬхНсЙЙЃЌбєРызгЕФНсЙЙШчЭМЫљЪОЁЃИУХфКЯЮяЕФЛЏбЇЪНЮЊ ЃЌбєРызгжаДцдкЕФЛЏбЇМќРраЭга ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжаПЦдКДѓСЌЛЏбЇЮяРэбаОПЫљЕФвЛЯюзюаТГЩЙћЪЕЯжСЫМзЭщИпаЇЩњВњввЯЉЃЌМзЭщдкДпЛЏзїгУЯТЭбЧтЃЌдкЦјЯржаОздгЩЛљХМСЊЗДгІЩњГЩввЯЉЃЌШчЭМЫљЪОЁЃ

ЃЈ1ЃЉЯжДњЪЏгЭЛЏЙЄВЩгУAgзїДпЛЏМСЃЌПЩЪЕЯжввЯЉгыбѕЦјжЦБИXЃЈЗжзгЪНC2H4OЃЌВЛКЌЫЋМќЃЉЃЌИУЗДгІЗћКЯзюРэЯыЕФдзгОМУЃЌдђЗДгІЕФЛЏбЇЗНГЬЪНЪЧ___ЃЈгаЛњЮяЧыаДНсЙЙМђЪНЃЉЁЃ
ЃЈ2ЃЉвбжЊЯрЙиЮяжЪЕФШМЩеШШШчЩЯБэЃЌаДГіМзЭщжЦБИввЯЉЕФШШЛЏбЇЗНГЬЪН___ЁЃ
ЃЈ3ЃЉдк400ЁцЪБЃЌЯђГѕЪМЬхЛ§1LЕФКубЙЗДгІЦїжаГфШы1molCH4ЃЌЗЂЩњЩЯЪіЗДгІЃЌВтЕУЦНКтЛьКЯЦјЬхжаC2H4ЕФЬхЛ§ЗжЪ§ЮЊ20.0%ЁЃдђЃК
ЂйдкИУЮТЖШЯТЃЌЦфЦНКтГЃЪ§K=__ЁЃ
ЂкШєЯђИУШнЦїЭЈШыИпЮТЫЎеєЦјЃЈВЛВЮМгЗДгІЃЌИпгк400ЁцЃЉЃЌC2H4ЕФВњТЪНЋ__ЃЈбЁЬюЁАдіДѓЁБЁАМѕаЁЁБЁАВЛБфЁБЁАЮоЗЈШЗЖЈЁБЃЉЃЌРэгЩЪЧ___ЁЃ
ЂлШєШнЦїЬхЛ§ЙЬЖЈЃЌВЛЭЌбЙЧПЯТПЩЕУБфЛЏШчЭМЃЌдђбЙЧПЕФЙиЯЕЪЧ___ЁЃ

ЂмЪЕМЪжЦБИC2H4ЪБЃЌЭЈГЃДцдкИБЗДгІЃК2CH4(g)ЁњC2H6(g)ЃЋH2(g)ЁЃЗДгІЦїКЭCH4Ц№ЪМСПВЛБфЃЌВЛЭЌЮТЖШЯТC2H6КЭC2H4ЕФЬхЛ§ЗжЪ§гыЮТЖШЕФЙиЯЕЧњЯпШчЭМЁЃ
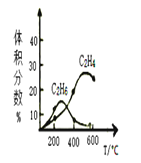
дк200ЁцЪБЃЌВтГіввЭщЕФСПБШввЯЉЖрЕФжївЊдвђПЩФмЪЧ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТЬдЫсЪЧПЇЗШЕФШШЫЎЬсШЁвКГЩЗжжЎвЛЃЌНсЙЙМђЪНШчЭМЃЌЙигкТЬдЫсХаЖЯе§ШЗЕФЪЧ( )
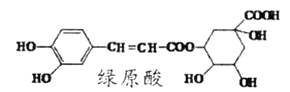
A.ТЬдЫсЗжзгЪНЮЊC16H13O9
B.ЗжзгжаЫљгаЕФЬМдзгОљПЩФмдкЭЌвЛЦНУцФк
C.1 molТЬдЫсгызуСПфхЫЎЗДгІЃЌзюЖрЯћКФ2.5mol Br2
D.1molТЬдЫсгызуСПNaOHШмвКЗДгІЃЌзюЖрЯћКФ4mol NaOH
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПББОЉАТдЫЛсЦкМфЖдДѓСПХшддЯЪЛЈЪЉгУСЫSЉгеПЙЫижЦМСЃЌвдБЃГжЯЪЛЈЪЂПЊЃЌSЉгеПЙЫиЕФЗжзгНсЙЙШчЭМЃЌЯТСаЙигкИУЗжзгЕФЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ

AЃЎКЌгаЬМЬМЫЋМќЁЂєЧЛљЁЂєЪЛљЁЂєШЛљ
BЃЎКЌгаБНЛЗЁЂєЧЛљЁЂєЪЛљЁЂєШЛљ
CЃЎ1molИУЗжзгФмгыКЌ2mol NaOHЕФШмвКЭъШЋЗДгІ
DЃЎИУЗжзгФмгыфхЫЎЗДгІЖјЪЙфхЫЎЭЪЩЋЧв1molФмгы4 mol Br2ЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзЭщгыбѕЦјЗДгІЙ§ГЬжаЕФФмСПБфЛЏШчЭМЫљЪОЁЃЯТСагаЙиЫЕЗЈжае§ШЗЕФЪЧ(ЁЁЁЁ)
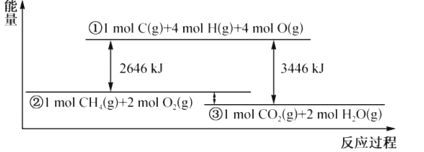
A.CH4(g)ЕФФмСПДѓгкCO2(g)КЭH2O(g)ЕФФмСПзмКЭ
B.ЗДгІCH4(g)+2O2(g)ЈTCO2(g)+2H2O(l) ЁїH=-800kJmol-1
C.дкЗДгІCH4(g)+2O2(g)ЈTCO2(g)+2H2O(g)жаЃЌЗХГіШШСП400kJЃЌга1mol O-HМќЩњГЩ
D.ШєЦЦЛЕ1molO2(g)жаЕФЛЏбЇМќашЮќЪеШШСП493kJЃЌдђЦЦЛЕ1mol C-HМќашЮќЪеШШСП415kJ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com