
【题目】(15分)周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子。回答下列问题:
(1)Y、Z、T中第一电离能最大的是 (填元素符号,下同),原子半径最小的是 。
(2)T的原子结构示意图为 ,W基态原子的电子排布式为 。
(3)X和上述其他元素中的一种形成的化合物中,分子呈三角锥形的是 (填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写一种)。
(4)T与Z形成的化合物中,属于非极性分子的是 (填化学式)。
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,阳离子的结构如图所示。该配合物的化学式为 ,阳离子中存在的化学键类型有 。
【答案】(1)N O (各1分) (2)![]() (1分) [Ar]3d104s1(2分)
(1分) [Ar]3d104s1(2分)
(3)NH3 (2分) H2O2或N2H4 (2分) (4)SO3 (2分)
(5)[Cu(NH3)4]SO4 (2分) 共价键、配位键(2分)
【解析】
试题周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,则X是氢元素。Y基态原子的p电子数比s电子数少1个,则Y应该是氮元素。Z基态原子的价电子层中有2个未成对电子,所以Z是氧元素。T与Z同主族,则T是S元素。W基态原子的M层全充满,N层只有一个电子,则W是Cu元素。
(1)非金属性越强,第一电离能越大。但氮元素的2p轨道电子处于半充满状态,稳定性强,则氮元素的第一电离能大于氧元素的。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径最小的是O。
(2)S的原子序数是16,原子结构示意图为![]() 。根据核外电子排布规律可知W基态原子的电子排布式为[Ar]3d104s1。
。根据核外电子排布规律可知W基态原子的电子排布式为[Ar]3d104s1。
(3)X和上述其他元素中的一种形成的化合物中,分子呈三角锥形的是NH3。分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2或N2H4。
(4)T与Z形成的化合物中,SO2是V形结构,三氧化硫是平面三角形,则属于非极性分子的是SO3。
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,则为硫酸根。阳离子的结构如右图所示,即为氨气和铜离子形成的配位健,则该配合物的化学式为[Cu(NH3)4]SO4,阳离子中存在的化学键类型有配位健及氮元素与氢原子之间的共价键。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.已知KCl与MgO的晶体结构跟NaCl的晶体结构相似,则晶体的熔点:MgO>KCl>NaCl
B.向滴有酚酞的碳酸钠溶液中加入BaCl2溶液,溶液褪色
C.分散系中分散质粒子的直径:Fe(OH)3胶体>Fe(OH)3悬浊液>FeCl3溶液
D.Na2O、MgO、Al2O3均属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)基态Ni原子的价电子排布式是___。
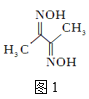
(2)丁二酮肟(结构简式如图1所示)中碳原子的杂化方式为___。丁二酮肟中C、N、O第一电离能由大到小的顺序为___。1mol丁二酮肟分子中含有σ键的数目为___mol。
(3)Ni(CO)4是一种无色液体,与CO互为等电子体的二价阴离子的电子式为___。
(4)图2是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金含有Ni的数目为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运送“神舟”五号飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为_________。
(2)该物质与液态双氧水反应能产生两种无毒又不污染环境的物质,写出该反应的化学方程式_______________________。
(3)NH3分子中的N原子有一对孤对电子 能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。

根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__。比较X、Y、Z的简单离子半径大小为__<____<__(用离子符号表示);
(2)元素的非金属性Y__J(填“>”或“<”)。下列各项中,不能说明这一结论的有__(填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____(填化学式);酸根呈三角锥结构的酸是___(填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O;②
RCH=CHCHO+H2O;②![]() 。
。
回答下列问题:
(1)C的结构简式为_______________________。
(2)F中官能团的名称为___________________。
(3)B与新制Cu(OH)2悬浊液反应的化学方程式为________________。
(4)从转化流程图可见,由D到E分两步进行,其中第一步反应的类型为__________。
(5)化合物G的二氯代物有__________种同分异构体。
(6)芳香化合物X是D的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有3种化学环境的氢,峰面积之比为6∶1∶1,符合条件的X的结构共有多种,任写出2种符合要求的X的结构简式________、___________。
(7)写出用甲醛和乙醛为原料制备化合物CH2=CHCOOCH3的合成路线(其他试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
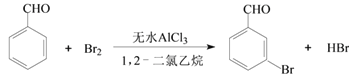
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
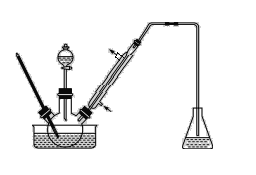
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com