
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )
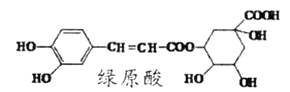
A.绿原酸分子式为C16H13O9
B.分子中所有的碳原子均可能在同一平面内
C.1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2
D.1mol绿原酸与足量NaOH溶液反应,最多消耗4mol NaOH
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】氟硼酸亚锡[Sn(BF4)2]用于粮食制品中防止有机酸的腐蚀。受热或遇水易分解或水解,长期放置在空气中易氧化。以氟硅酸(H2SiF6,二元强酸,易溶于水,其钠盐溶解度较小、硼酸[H3BO3],一元弱酸,酸根为![]() 等为原料制备氟硼酸亚锡,同时得白炭黑(SiO2)和Na2SiF6等副产物的工艺流程如图所示。
等为原料制备氟硼酸亚锡,同时得白炭黑(SiO2)和Na2SiF6等副产物的工艺流程如图所示。

(1)硼酸在水溶液中的电离方程式_____。硼酸水溶液中水的电离程度_____(填“大于”或“小于”或“等于”)同温度下纯水的电离程度。
(2)流程中过程③由锡石制备锡一般工业上加入焦炭,该方法冶炼锡属于哪种冶金方法_____。
A.热分解法 B.电解法 C.热还原法
(3)写出反应④发生的主要反应的化学方程式_____。
(4)原料经反应①过滤后得残留氟硅酸(H2SiF6)杂质的氟硼酸(HBF4)溶液,写出反应①的化学方程式_____。
(5)离心分离前步骤②加NaCl的目的是_____。
(6)氟硼酸亚锡[Sn(BF4)2]的正确保存方法_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。

根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__。比较X、Y、Z的简单离子半径大小为__<____<__(用离子符号表示);
(2)元素的非金属性Y__J(填“>”或“<”)。下列各项中,不能说明这一结论的有__(填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____(填化学式);酸根呈三角锥结构的酸是___(填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O;②
RCH=CHCHO+H2O;②![]() 。
。
回答下列问题:
(1)C的结构简式为_______________________。
(2)F中官能团的名称为___________________。
(3)B与新制Cu(OH)2悬浊液反应的化学方程式为________________。
(4)从转化流程图可见,由D到E分两步进行,其中第一步反应的类型为__________。
(5)化合物G的二氯代物有__________种同分异构体。
(6)芳香化合物X是D的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有3种化学环境的氢,峰面积之比为6∶1∶1,符合条件的X的结构共有多种,任写出2种符合要求的X的结构简式________、___________。
(7)写出用甲醛和乙醛为原料制备化合物CH2=CHCOOCH3的合成路线(其他试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某有机物的分子式为C3H8O,红外光谱和核磁共振氢谱如下图, 氢谱三个峰的面积之比分别为1∶1∶6, 写出其结构简式_____________ (写一种)。


(2)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①烃A的分子式为_____________。
②若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为_______________,_____________ ,______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
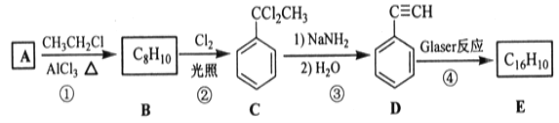
回答下列问题:
(1)B的结构简式为____,D的化学名称为___。
(2)①和③的反应类型分别为____、___。
(3)E的结构简式为___。用1 molE合成1,4-二苯基丁烷,理论上需要消耗氢气___mol。
(4)写出上述步骤④的化学方程式为____。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是存在于燃气中的一种有害气体,脱除H2S的方法有很多。
(1)国内有学者设计了“Cu2+一沉淀氧化”法脱除H2S。该法包括生成CuS沉淀,氧化CuS(Cu2++CuS+4Cl—=S+2CuCl2—)及空气氧化CuCl2—再生Cu2+。
①反应H2S(aq)+Cu2+(aq)CuS(s)+2H+(aq)的K=__________
②再生Cu2+反应的离子方程式为____________。
(2)采用生物脱硫技术时,H2S与碱反应转化为HS-,在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2。当33.6 m3(标准状况)某燃气(H2S的含量为0.2%)脱硫时,消耗NO3—的物质的量为___mol。
(3)已知下列热化学方程式:
Ⅰ.H2(g)+![]() O2(g)=H2O(l) H1=-285.8kJmol-1
O2(g)=H2O(l) H1=-285.8kJmol-1
Ⅱ. H2(g)+S(s)=H2S(g) H2=-20.6kJmol-1
Ⅲ.S(s)+O2(g)=SO2(g) H3=-296.8kJmol-1
则以Claus法脱除H2S的反应:2H2S(g)+SO2 (g)=3S(s)+2H2O(1) △H=________kJ/mol。
(4)101 kPa下,H2S分解:2H2S(g) 2H2(g)+S2(g)。保持压强不变,反应达到平衡时,气体的体积分数(φ)随温度的变化曲线如图:
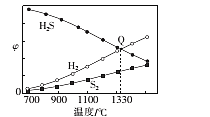
①在密闭容器中,关于反应2H2S(g) 2H2(g)+S2 (g)的说法正确的是____(填字母)。
A.Kp随温度的升高而增大
B.低压有利于提高HpS的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则v(正)<v(逆)
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点:H2S的平衡转化率为____;S2(g)的分压为____kPa;1330℃时,反应2H2S(g) 2H2(g)+S2(g)的Kp=_____(Kp为以分压表示的平衡常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com