
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4nH2O)既是高效洁净的能源,也是重要的化工原料。
①可燃冰(mCH4nH2O)属于_____晶体,写出CH4的结构式______。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的 △H=___kJ/mol。
(2)用甲烷--氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:

①b电极名称为______,d电极的电极反应式为__________。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗的氧气在标准状兄下的体积是_______mL。
(3)25℃,101kPa条件下,14gN2和3gH2反应生成NH3的能量变化如下图所示:
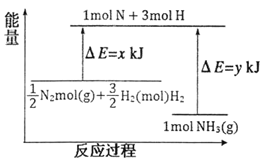
已知:①x=1127;
②25℃,101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJmol-1。则y=______。
2NH3(g) △H=-92kJmol-1。则y=______。
【答案】 分子 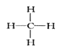 -890.4 正极 Cu2++2e-=Cu 560 1173
-890.4 正极 Cu2++2e-=Cu 560 1173
【解析】(1)①甲烷为四面体结构,mCH4nH2O的熔沸点较低,为分子晶体;CH4为共价化合物,碳氢键以单键结合,其结构式为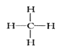 ;正确答案:分子;
;正确答案:分子;  。
。
②1g甲烷完全燃烧生成液态水放出55.64kJ热量,则1mol甲烷燃烧放出的能量为16×55.65=890.4kJ;CH4(g)+2O2(g)=CO2(g)+2H2O(l)的 △H=-890.4 kJ/mol;正确答案:-890.4。
(2)①a极通的是燃料甲烷,所以是负极;通入氧气的为正极;d电极与电源的负极相连,为电解池的阴极,发生还原反应,电极反应式为Cu2++2e-=Cu;正确答案:正极; Cu2++2e-=Cu 。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,整个电路转移的物质的量为![]() ×2=0.05mol×2=0.1mol,消耗氧气的物质的量为
×2=0.05mol×2=0.1mol,消耗氧气的物质的量为![]() ×2=0.025mol,所以需氧气的体积为0.025mol×22.4L/mol=0.56L=560mL;正确答案:560。
×2=0.025mol,所以需氧气的体积为0.025mol×22.4L/mol=0.56L=560mL;正确答案:560。
(3)该反应放热H<0,反应热=反应物的总键能-生成物的总键能,氮气和氢气反应生成氨气的热化学方程式为:1/2N2(g)+3/2H2(g)=NH3(g) △H=x-y kJmol-1,则N2(g)+3H2(g)=2NH3(g)△H=2(x-y)kJmol-1=-92kJmol-1,所以x-y=-46,又因x=1127,所以y=1173;正确答案:1173。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若原子X的质子数为a,则X的质量数一定不为a
B.若两种元素形成的离子M2﹣和N+电子层结构相同,则离子半径M2﹣>N+
C.同周期非金属氧化物对应水化物酸性从左到右依次增强
D.由两种元素组成的化合物,若含有离子键,就没有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
I. ①H、D、T ②H2O、D2O ③石墨、金刚石 ④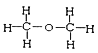 和
和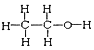
四组微粒或物质中,互为同位素的是_______;(填序号,下同)互为同素异形体的是_____。
II.现有①金刚石 ②干冰 ③Na2SO4 ④NH4Cl 四种物质,按下列要求回答:
(1)晶体熔化时需要破坏共价键的是_____(填序号,下同);
(2)熔点最低的是_______
(3)晶体中只存在一种微粒作用力是_______;
(4)属于离子晶体的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,燕令气.上……其清如水,味极浓烈,盖酒露也。“”这里所用的“法”是指
A. 萃取 B. 渗析 C. 蒸馏 D. 升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_____________ (用元素符号表示,下同)。
(2)写出W的价电子排布式__________________________,W同周期的元素中,与W原子最外层电子数相等的元素还有_____________。
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是__________________________(用化学式表示),原因是__________________________。
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_____________,该物质硬度大,推测该物质为_____________晶体。其中Y元素的杂化方式是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物。下列说法正确的是

A. 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大。
B. 根据图形分析可知,K、L两种元素最高价氧化物对应的水化物的酸性,前者较强。
C. 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同。
D. 元素K、H、G分别形成的简单离子的半径逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出四种元素的名称:A________B_______C__________D_________
(2)用电子式表示化合物A2B的形成过程:______________________。
(3)写出D元素形成的单质的结构式:__________________________。
(4)A、B两种元素组成的化合物A2B2存在的化学键是________________。
(5)写出下列物质的电子式:E与B形成的化合物__________________;A、B、E形成的化合物_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论错误的是( )
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和K2O都属于盐
B.KOH和Na2CO3都属于碱
C.H2SO4和HNO3都属于酸
D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com