
【题目】HA、H2B是两种弱酸,H2B+A-=HB-+HA, B2-+HA=HB-+A-则下列说法正确的是 ( )
A.H2B的电离方程式为:H2B![]() 2H+ + B2-
2H+ + B2-
B.结合质子能力由强到弱的顺序为:B2->A->HB-
C.等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D.等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
【答案】B
【解析】
试题分析:已知:H2B+A-=HB-+HA,B2-+HA=HB-+A-,则酸性:H2B>HA>HB-。A.H2B为二元弱酸,则其的电离方程式为:H2BH++HB-,故A错误;B.酸性:H2B>HA>HB-,酸性越强,其阴离子结合质子的能力越弱,则B2->A->HB-,故B正确;C.酸性:H2B>HA>HB-,酸性越强,其阴离子水解能力越弱,则等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,Na2B水解能力最强,碱性最强,故C错误;D.等pH的HA、H2B两种溶液中,酸电离出来的氢离子相同,则对水的抑制程度相同,所以水的电离出的氢离子前者等于后者,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液加入金属铝能放出氢气。下列各组离子在该溶液中一定可以大量共存的是
A.Al3+、NH4+、Cl-、SO42-
B.Na+、Cl-、SO42-、HCO3-
C.Na+、CH3COO-、NO3- 、K+
D.K+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。G单质是日常生活中用量最大的金属,易被腐蚀。
试回答下列问题:
(1)A元素的同位素有___________(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为_________________________
(3)C、D、E、F的简单离子半径由大到小的顺序是_________________(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱_____________________(举一例)
(5)下列有关G的说法不正确的是_______
A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示。请写出t2时反应的总的化学方程式 _____________________ 。
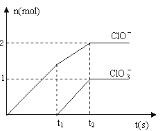
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在容积为3 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
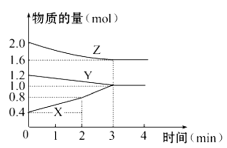
(1)该反应的化学方程式为____________ _______。
(2)反应开始至2 min末,X的反应速率为_____ ____。
(3)该反应是由__________(填序号)开始的。
①正反应 ②逆反应 ③正、逆反应同时
(4)若增加Y的用量,化学反应速率不变化,则Y为__ ___态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )

A. PbO2是电池的负极
B. SO42-向Pb极移动
C. PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
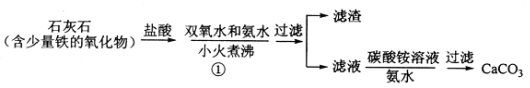
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
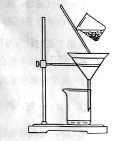
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
CaCO3![]() 滤液
滤液![]()
![]() 白色晶体
白色晶体
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Q、R、Z、T、U分别代表原子序数依次增大的元素。X是原子半径最小的元素,短周期中Q原子含有的未成对电子数最多,R和T属同族,T的原子序数是R的两倍,Z的单质的同周期中熔点最高;U5+的核外电子排布和氩元素相同。
(1)U基态原子的原子结构示意图为 。
(2)在(QX4)2TR4的晶体中存在的化学键类型有 。
a.离子键 b.共价键 c.配位键 d.金属键
(3)Q、R、T所对应元素的第一电离能由大到小的顺序是 (填元素符号)。
(4)TR2是 分子(填“极性”或“非极性”)。ZR2晶体结构如图I,6g ZR2中所含Z—R键的数目为 。
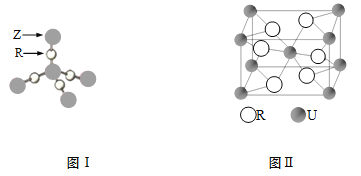
(5)U和R形成的化合物的晶胞结构如图II所示,该化合物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com