
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。G单质是日常生活中用量最大的金属,易被腐蚀。
试回答下列问题:
(1)A元素的同位素有___________(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为_________________________
(3)C、D、E、F的简单离子半径由大到小的顺序是_________________(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱_____________________(举一例)
(5)下列有关G的说法不正确的是_______
A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
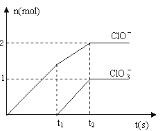
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示。请写出t2时反应的总的化学方程式 _____________________ 。
【答案】(1)1H2H3H或H D T
(2)2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(3) S2- >Cl->O2-> Al3+;
(4)与H2化合Cl2比S容易;或:HCl比H2S要稳定;或:2H2S+Cl2 =2S+2HCl(任意一例)
(5)ABD
(6)5Cl2+10 NaOH=7NaCl+2NaClO+NaClO3+5H2O
【解析】试题分析:A是周期表中原子半径最小的元素,A是H;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐,B是N;C元素原子的最外层电子数是内层电子数的3倍,C是O;D元素的主族序数等于其周期数,D是Al;E元素原子的最外层电子数是其电子层数的2倍,E是S。F是Cl;G单质是日常生活中用量最大的金属,易被腐蚀,G是Fe。
(1)A元素的同位素有1H2H3H
(2)实验室制取氨气的化学反应方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(3)电子层数越多半径越大、电子层数相同时,质子数越多半径越小,离子半径由大到小的顺序是S2- >Cl->O2-> Al3+
(4)2H2S+Cl2 =2S+2HCl,说明氯元素非金属性比硫的强。
(5)下列有关G的说法不正确的是_______
A、铁位于第四周期Ⅷ族,在人体内的血红蛋白中含有铁元素;
B、过量的铁分别与氯气生成氯化铁,铁与稀盐酸反应生成氯化亚铁;
C、铁与氯气化合生成FeCl3、氯化铁与铁化合生成FeCl2、氢氧化亚铁和氧气和水化合才Fe(OH)3;
D、氢氧化铁与HI溶液发生氧化还原反应、中和反应
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示。根据氧化还原反应规律, t2时生成物中有三种含Cl的离子是氯离子、次氯酸根离子、氯酸根离子,反应的总的化学方程式5Cl2+10 NaOH=7NaCl+2NaClO+NaClO3+5H2O。


科目:高中化学 来源: 题型:
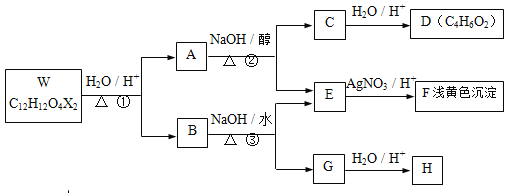
【题目】有机物W~H 有如下的转化关系。已知W、B为芳香族化合物,X为卤素原子,W、A、B均能与NaHCO3溶液反应,A分子中有2个甲基,H分子中含有醛基且苯环上的取代基处于对位。
已知:
请回答下列有关问题:
(1)反应①、②分别属于 反应、 反应(填有机反应类型),A、B中均含有的含氧官能团的名称是 。
(2)F的化学式 ,B的结构简式 。
(3)反应②的化学方程式是 。
(4)若![]()
则反应④的化学方程式是 。
(5)H有多种同分异构体,且满足下列3个条件
(i) 遇FeCl3显紫色 (ii)苯环上一取代物有两种 (ⅲ)除苯环外无其它环状结构
试写出三种符合条件的同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家冶炼出纯度高达99.9999%的铁。你估计它不会具有的性质是
A. 硬度比生铁低 B. 与4mol/L的HCl反应时速率比生铁快
C. 在冷的浓硫酸中可钝化 D. 在潮湿的空气中不易生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的说法中正确的是( )
A.都只由C、H、O三种元素组成
B.都是食物中的基本营养物质
C.都能发生水解反应
D.都能与银氨溶液发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
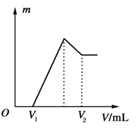
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是:____________。
(2)硅与铝同周期.地壳里硅铝的含量硅____________铝(填>,<或=)。工业上制备金属铝的化学方程式是: ____________,工业上制备硅的化学方程式有:
a.SiO2+2C![]() Si(粗)+2CO
Si(粗)+2CO
b.SiO2+3C![]() SiC +2CO(副反应),
SiC +2CO(副反应),
c.Si(粗)+ 2C12![]() SiCl4
SiCl4
d.SiC14 + 2H2![]() Si+4HC1,
Si+4HC1,
某同学将氧化还原反应、非氧化还原反应及四大基本反应绘制成上图,其中属于上图“2"区域的反应是____________ (填序号)。

(3)SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2OCaO6SiO2,钠长石(NaAlSi3O8)的氧化物形式____________,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同.由此可推知钙长石的化学式为____________。
(4)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A 份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是n(Si)____________和n(Mg)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HA、H2B是两种弱酸,H2B+A-=HB-+HA, B2-+HA=HB-+A-则下列说法正确的是 ( )
A.H2B的电离方程式为:H2B![]() 2H+ + B2-
2H+ + B2-
B.结合质子能力由强到弱的顺序为:B2->A->HB-
C.等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D.等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种工业制备SrCl2·6H2O的生产流程如下:
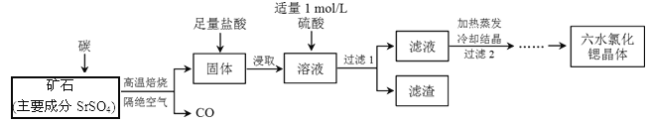
已知:①M(SrCl2·6H2O)=267 g/mol;
② Kap(SrSO4)= 3.3×10-7、Kap(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质。
(1)隔绝空气高温焙烧,若2 mol SrSO4中只有S被还原,转移了16mol电子。写出该反应的化学方程式:_____________________________________________。
(2)过滤2后还需进行的两步操作是______、_________。
(3)加入硫酸的目的是_________________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为____________(保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com