
【题目】一种工业制备SrCl2·6H2O的生产流程如下:
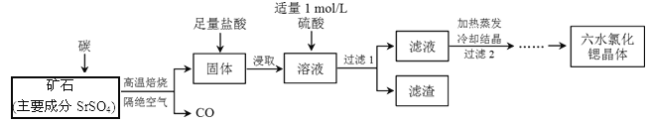
已知:①M(SrCl2·6H2O)=267 g/mol;
② Kap(SrSO4)= 3.3×10-7、Kap(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质。
(1)隔绝空气高温焙烧,若2 mol SrSO4中只有S被还原,转移了16mol电子。写出该反应的化学方程式:_____________________________________________。
(2)过滤2后还需进行的两步操作是______、_________。
(3)加入硫酸的目的是_________________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为____________(保留4位有效数字)。
【答案】(1)SrSO4+4C![]() SrS+4CO↑;(2)洗涤;干燥;(3)除去Ba2+杂质;0.03;
SrS+4CO↑;(2)洗涤;干燥;(3)除去Ba2+杂质;0.03;
(4)①加入最后一滴标准液,溶液由无色变为红色,且30s不褪色 ②93.45%。
【解析】
试题分析:(1)隔绝空气高温焙烧,若2 mol SrSO4中只有S被还原,转移了16mol电子。则每1molS 获得8mol电子,元素化合价降低8价,由于原来是+6价,所以反应后变为-2价,根据电子守恒、原子守恒,则该反应的化学方程式是SrSO4+4C![]() SrS+4CO↑;(2)过滤2后的溶液为SrCl2,该物质的溶解度随温度的升高而增大,随温度的降低而减小,所以从溶液中获得SrCl2·6H2O,还需进行的两步操作是洗涤;干燥,就得到纯净的SrCl2·6H2O,(3)由于BaSO4是难溶于水的物质,所以在操作过程中加入硫酸目的是使溶液中的Ba2+形成BaSO4沉淀,而除去Ba2+杂质;Kap(BaSO4)=1.1×10-10,由于溶液中Ba2+浓度为1×10-5 mol/L,则c(SO42-)=1.1×10-10÷1×10-5 mol/L=1.1×10-5 mol/L,根据Kap(SrSO4)= 3.3×10-7可知c(Sr2+)=3.3×10-7÷1.1×10-5 mol/L=3.0×10-2 mol/L=0.03mol/L;(4)①若NH4SCN不再与剩余的Ag+结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时再滴加最后一滴溶液,溶液由无色变为血红色,且30 s不褪色;②n(NH4SCN)= 0.2000 mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=1/2 n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=33.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:(0.9435g÷1g)×100%=93.45%。
SrS+4CO↑;(2)过滤2后的溶液为SrCl2,该物质的溶解度随温度的升高而增大,随温度的降低而减小,所以从溶液中获得SrCl2·6H2O,还需进行的两步操作是洗涤;干燥,就得到纯净的SrCl2·6H2O,(3)由于BaSO4是难溶于水的物质,所以在操作过程中加入硫酸目的是使溶液中的Ba2+形成BaSO4沉淀,而除去Ba2+杂质;Kap(BaSO4)=1.1×10-10,由于溶液中Ba2+浓度为1×10-5 mol/L,则c(SO42-)=1.1×10-10÷1×10-5 mol/L=1.1×10-5 mol/L,根据Kap(SrSO4)= 3.3×10-7可知c(Sr2+)=3.3×10-7÷1.1×10-5 mol/L=3.0×10-2 mol/L=0.03mol/L;(4)①若NH4SCN不再与剩余的Ag+结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时再滴加最后一滴溶液,溶液由无色变为血红色,且30 s不褪色;②n(NH4SCN)= 0.2000 mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=1/2 n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=33.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:(0.9435g÷1g)×100%=93.45%。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。G单质是日常生活中用量最大的金属,易被腐蚀。
试回答下列问题:
(1)A元素的同位素有___________(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为_________________________
(3)C、D、E、F的简单离子半径由大到小的顺序是_________________(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱_____________________(举一例)
(5)下列有关G的说法不正确的是_______
A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
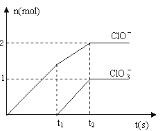
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示。请写出t2时反应的总的化学方程式 _____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )

A. PbO2是电池的负极
B. SO42-向Pb极移动
C. PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
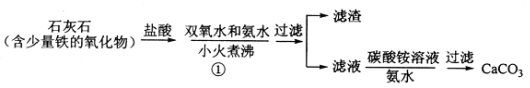
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
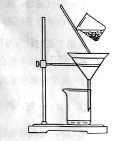
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
CaCO3![]() 滤液
滤液![]()
![]() 白色晶体
白色晶体
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定分散系中可以大量存在的粒子组是
A.在空气中:H2、NH3、NO、CO2
B.在K2CO3溶液中:Na+、H+、Cl-、Br-
C.在无水乙醇的CCl4溶液中:Br2、I2、苯、甲醇
D.在Fe(NO3)2溶液中:H+、SO42-、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
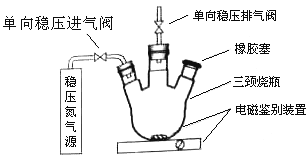
1、测定原理:
碱性体积下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-=2 MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200ml水样
c.向烧瓶中依次迅速加入1mlMnSO4无氧溶液(过量)2ml碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2ml硫酸无氧溶液至反应②完全,溶液为中性或若酸性。
e.从烧瓶中取出40.00ml溶液,以淀粉作指示剂,用0.001000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50ml,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填是或否)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于等质量的14CO2与N218O的说法不正确的是
A.分子数之比为1 : 1 B.原子数之比为1:1
C.密度之比为1 : 1 D.中子数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Q、R、Z、T、U分别代表原子序数依次增大的元素。X是原子半径最小的元素,短周期中Q原子含有的未成对电子数最多,R和T属同族,T的原子序数是R的两倍,Z的单质的同周期中熔点最高;U5+的核外电子排布和氩元素相同。
(1)U基态原子的原子结构示意图为 。
(2)在(QX4)2TR4的晶体中存在的化学键类型有 。
a.离子键 b.共价键 c.配位键 d.金属键
(3)Q、R、T所对应元素的第一电离能由大到小的顺序是 (填元素符号)。
(4)TR2是 分子(填“极性”或“非极性”)。ZR2晶体结构如图I,6g ZR2中所含Z—R键的数目为 。
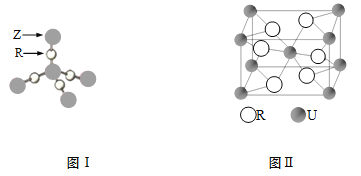
(5)U和R形成的化合物的晶胞结构如图II所示,该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2。
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(2)异戊二烯的一种制备方法如下图所示:
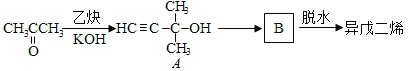
A能发生的反应有___________。(填反应类型)
B的结构简式为______________。
(3)设计一条由异戊二烯制得有机合成中间体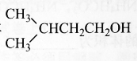 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com