
【题目】某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
乙醛溶液进行下列实验.
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
(1)上表中a、b应为(填字母序号)。___________________
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是___________。
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀。该反应的化学方程式为_________。
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是_______________。
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是__________________基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
【答案】B 2NaOH + 2CuSO4=== Cu2(OH)2SO4↓ + Na2SO4 乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化) 此题答案可从“现象”或“理论”两个角度提出依据。依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物。依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物。 CH3CHO + 2Cu(OH)2+ NaOH![]() CH3COONa + Cu2O↓ + 3H2O 溶液变为蓝色,有红色固体 将1 mL 2%CuSO4溶液与3 mL(或>3 mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5 mL 40%的乙醛溶液,水浴加热
CH3COONa + Cu2O↓ + 3H2O 溶液变为蓝色,有红色固体 将1 mL 2%CuSO4溶液与3 mL(或>3 mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5 mL 40%的乙醛溶液,水浴加热
【解析】
(1)本实验探究NaOH的用量对反应产物的影响,实验1和2、3和4中NaOH的量不同,硫酸铜的量必须相同;
(2)依据原子守恒书写NaOH与CuSO4生成Cu2(OH)2SO4的方程式;实验1、2没有出现红色沉淀,说明乙醛未参与氧化反应;
(3)解答时可从“现象”或“理论”两个角度提出依据;
(4)乙醛能够被新制氢氧化铜氧化为乙酸,乙酸与NaOH反应生成乙酸钠;
(5)Cu2O在酸性溶液中可转化为Cu2+、Cu,Cu2+为蓝色,Cu为红色;
(6)探究[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀,可以加入过量NaOH溶液。
(1)本实验探究NaOH的用量对反应产物的影响,实验1和2、3和4中NaOH的量不同,硫酸铜的量必须相同,因此a为2mL,b为1 mL,答案选B;
(2)NaOH与CuSO4生成Cu2(OH)2SO4,反应方程式为:2NaOH+ 2CuSO4= Cu2(OH)2SO4↓ + Na2SO4;实验1、2没有出现红色沉淀,说明乙醛未参与氧化反应(或是含铜元素的化合物在发生变化);
(3)依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物。依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物;
(4)乙醛能够被新制氢氧化铜氧化为乙酸,乙酸与NaOH反应生成乙酸钠,反应方程式为:CH3CHO + 2Cu(OH)2+ NaOH![]() CH3COONa + Cu2O↓ + 3H2O;
CH3COONa + Cu2O↓ + 3H2O;
(5)Cu2O在酸性溶液中可转化为Cu2+、Cu,所以溶液变为蓝色,生成红色固体;
(6)探究[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀,可以加入过量NaOH溶液,将1 mL2%CuSO4溶液与3 mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5 mL 40%的乙醛溶液,水浴加热。


科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如下:
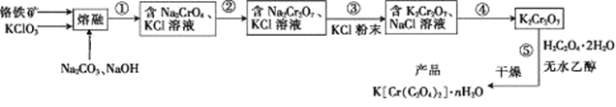
回答下列问题:
(1)若“熔融”在坩埚中进行,其材质可以是____(填“铁”、“陶瓷”或“SiO2”)。
(2) FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____________________________。
(3)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤;二是调节所得滤液pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为______,第二次过滤滤渣的主要成分为_________。
(4)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为___________。
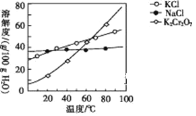
(5)步骤④包含的具体操作有_____、_____,过滤、洗涤,再经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
(6)已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的是 ( )
①打开雪碧的瓶盖,立即有气体逸出 ②由 H2、I2、HI 三种气体组成的平衡体系加压后颜色变深 ③可用浓氨水和氢氧化钠固体混合来快速制氨 ④煅烧粉碎的硫铁矿有利于 SO2生成 ⑤使用铁触媒,使 N2 和 H2 的混合气体有利于合成 NH3 ⑥将混合气体中的氨气液化有利于合成氨反应 ⑦500 ℃左右比室温更有利于合成 NH3 ⑧ 配制 FeCl2溶液时加入少量铁屑 ⑨ 实验室常用排饱和食盐水法收集 Cl2 ⑩推压装有 NO2 的注射器活塞,注射器内气体颜色先变深后变浅但比推压之前深
A.4 项B.5 项C.6 项D.7项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+![]() O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
A.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=+317.3kJ·mol-1
B.Zn+Ag2O=ZnO+2Ag ΔH=+317.3kJ·mol-1
C.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=-379.3kJ·mol-1
D.2Zn(s)+2Ag2O(s)=2ZnO(s)+4Ag(s) ΔH=-634.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸锶[Sr(NO3)2]常作为制备焰火、信号弹的原料。实验室以生产碳酸锶工厂的废渣(含SrCO338.40%,SrO12.62%,CaCO338.27%,BaCO32.54%,MgCO31.88%,其它不溶于硝酸的杂质6.29%)为原料制备硝酸锶粗品的部分实验过程如下:

表3 两种盐的溶解度(g/100g水)

(1)废渣粉碎的目的是_____。
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:①__;②__;③__;④洗涤,干燥。
(3)制得的硝酸锶粗品中含有少量Ca(NO3)2、Ba(NO3)2等杂质。实验室测定硝酸锶纯度的实验步骤如下:准确称取一定质量的硝酸锶样品,加入1∶1无水乙醇与乙醚的混合液萃取硝酸钙,用水溶解分离硝酸钙后的样品,于250mL容量瓶中定容得样品溶液。准确移取25.00mL样品溶液,调节pH为7,加入指示剂,加热至微沸,立即用碳酸钠标准溶液滴定至终点。另取样品溶液用比浊法测得硝酸钡的含量。滴定过程中反应的离子方程式为:Sr2++CO32-=SrCO3↓, Ba2++CO32-=BaCO3↓。
①滴定选用的指示剂为_____,滴定终点观察到的现象为_____。
②若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会_____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:
![]()
下列判断无法确定的是
A.PAFC因水解而能净水B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性D.乙溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备绿矾(FeSO4·7H2O)和聚铁(碱式硫酸铁的聚合物),其过程如下:

(1)若用浓硫酸配制过程①所需的250mL3.0mol·L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_____。
(2)过程②用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有_____(填仪器名称),该过程产生的尾气会对大气造成污染,可选用下列试剂中的_____吸收。
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是____,检验溶液X中金属阳离子是否完全转化的试剂为_____(填试剂名称)。
(4)过程④的操作是将溶液______、_____、过滤、洗涤,即得到FeSO4·7H2O晶体。过程⑥中,将溶液Z加热到70~80℃,目的是__。
(5)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )

A.AB段发生反应的离子方程式为Ba2++SO42-=BaSO4↓
B.BC段发生反应的离子方程式为H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3
D.E点时溶液中含有大量的AlO2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com