
����Ŀ�����в�������������ԭ�����͵��� �� ��
�ٴ�ѩ�̵�ƿ�ǣ������������ݳ� ���� H2��I2��HI ����������ɵ�ƽ����ϵ��ѹ����ɫ���� �ۿ���Ũ��ˮ���������ƹ������������ư� �����շ���������������� SO2���� ��ʹ������ý��ʹ N2 �� H2 �Ļ�����������ںϳ� NH3 ����������еİ���Һ�������ںϳɰ���Ӧ ��500 �����ұ����¸������ںϳ� NH3 �� ���� FeCl2��Һʱ����������м �� ʵ���ҳ����ű���ʳ��ˮ���ռ� Cl2 ����ѹװ�� NO2 ��ע����������ע������������ɫ�ȱ�����dz������ѹ֮ǰ��
A.4 ��B.5 ��C.6 ��D.7��
���𰸡�B
��������
��������ԭ����ָ��һ��ƽ����ϵ�У����ı�Ӱ��ƽ���һ��������ƽ������Ҫ���ܹ��������ָı�ķ����ƶ�������һ�����淴Ӧ�У������ӷ�Ӧ���Ũ��ʱ��ƽ��Ҫ������Ӧ�����ƶ���ƽ����ƶ�ʹ�����ӵķ�Ӧ��Ũ���ֻ����٣������ּ����������������ӷ�Ӧ��Ũ�ȶ����ַ�Ӧ�ﱾ����Ӱ�죬��ɵ�ƽ����ϵ�����ַ�Ӧ���Ũ����ȣ����������ˡ�
����Һ�д��ڶ�����̼���ܽ�ƽ��CO2+H2O![]() H2CO3���÷�Ӧ�ǿ��淴Ӧ�����Կ�������������ԭ�����ͣ��ٲ�ѡ��
H2CO3���÷�Ӧ�ǿ��淴Ӧ�����Կ�������������ԭ�����ͣ��ٲ�ѡ��
����H2+I2![]() 2HI����Ϊ���������������ȣ����Լ�ѹƽ�ⲻ�ƶ��������СŨ����������������ԭ�����ͣ���ѡ��
2HI����Ϊ���������������ȣ����Լ�ѹƽ�ⲻ�ƶ��������СŨ����������������ԭ�����ͣ���ѡ��
��һˮ�ϰ������笠����Ӻ����������ӣ����ڵ���ƽ�⣬������ʵĵ��������ȷ�Ӧ�������¶ȴٽ�һˮ�ϰ����룬NaOH����ˮ�ų��������൱�ڼ��ȣ����Դٽ�������ȡ���۲�ѡ��
�����շ����������������SO2���ɣ��ӿ췴Ӧ���ʣ�����Ӱ��ƽ����ƶ�����ѡ��
��ʹ������ý��ʹN2��H2�Ļ�����������ںϳ�NH3������ֻ�ı䷴Ӧ���ʣ���Ӱ��ƽ����ƶ�����ѡ��
�ϳɰ��ķ�Ӧ�У�����������еİ���Һ������С��������Ũ�ȣ�ƽ�����������ƶ���������ƽ���ƶ�ԭ�����ͣ���ѡ��
�ߺϳɰ����ȣ��¶����ߣ�ƽ�������ƶ�������500�����ұ����²����ںϳɰ��ķ�Ӧ����������������ԭ�����ͣ���ѡ��
������FeCl2��Һʱ����������м����ֹ��������������������������ԭ�����ͣ���ѡ��
��������ˮ�ķ�Ӧ����ʽΪ��Cl2+H2O![]() HCl+HClO���÷�Ӧ�ǿ��淴Ӧ�����Կ�������������ԭ�����ͣ��ѡ��
HCl+HClO���÷�Ӧ�ǿ��淴Ӧ�����Կ�������������ԭ�����ͣ��ѡ��
����ѹװ��NO2��ע����������ע������������ɫ�ȱ�����dz������ѹ֮ǰ�����Ϊ�����������������������ڻ�ѧƽ�⣬��ѹװ��NO2��ע��������������ѹǿ�������С��Ũ������ƽ�������������������ķ�����У�������������ԭ�����ͣ��ⲻѡ��
�ɼ���������������ԭ�����͵��Ǣڢܢݢߢ࣬������ʺ���ѡ����B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PET��![]() ��M����= 192 g��mol1�������������ϳ���ά�����ϡ���ijPET��Ʒ�Ķ˻����Ȼ������ʵ�����������ƽ���ۺ϶ȣ��Է�̪��ָʾ������c mol��L1 NaOH����Һ�ζ�m g PET�˻��е��Ȼ����յ㣨������ˮ��Һ��ͬ��������NaOH����Һv mL������˵������ȷ����
��M����= 192 g��mol1�������������ϳ���ά�����ϡ���ijPET��Ʒ�Ķ˻����Ȼ������ʵ�����������ƽ���ۺ϶ȣ��Է�̪��ָʾ������c mol��L1 NaOH����Һ�ζ�m g PET�˻��е��Ȼ����յ㣨������ˮ��Һ��ͬ��������NaOH����Һv mL������˵������ȷ����
A.PET������һ�ֿɽ���߷��Ӳ���
B.�ζ��յ�ʱ����Һ��Ϊdz��ɫ
C.�ϳ�PET��һ�ֵ������Ҵ���ͬϵ��
D.PET��ƽ���ۺ϶�![]() �����Զ˻���Ħ��������
�����Զ˻���Ħ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Ҹ���¡����ض�֤ʵ�������뵪���ڹ����������ϳɰ��ķ�Ӧ����,ʾ��ͼ���£�

![]()
���й��ںϳɰ���Ӧ�������в���ȷ����
A. �ù��̱���,�ڻ�ѧ��Ӧ�д��ڻ�ѧ���Ķ������γ�
B. �ڴ�����������,��Ӧ��Ļ�ѧ�����������
C. ���̢�����������,���̢���ų�����
D. �����¸÷�Ӧ���Խ���,����Ϊ������������Ļ�ѧ�������γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪֱ����Դ���ϡNa2SO4ˮ��Һ��װ�á�ͨ�����ʯī�缫a��b�����ֱ�μӼ���ʯ����Һ������ʵ����������ȷ���ǣ� ��

A.�ݳ�����������a�缫��С��b�缫��
B.һ�缫�ݳ���ζ���壬��һ�缫�ݳ��̼�����ζ����
C.a�缫�����ʺ�ɫ��b�缫��������ɫ
D.a�缫��������ɫ��b�缫�����ʺ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����з�Ӧ��ƽ�ⳣ������ֵ���£�
2NO(g)![]() N2(g)+O2(g)��K1=1��1030��
N2(g)+O2(g)��K1=1��1030��
2H2(g)+O2(g)![]() 2H2O(g)��K2=2��1081��
2H2O(g)��K2=2��1081��
2CO2(g)![]() 2CO(g)+O2(g)��K3=4��10��92��
2CO(g)+O2(g)��K3=4��10��92��
����˵����ȷ���ǣ� ��
A.�����£�NO�ֽ����O2�ķ�Ӧ��ƽ�ⳣ������ʽΪK1=c(N2)��c(O2)
B.�����£�ˮ�ֽ����O2����ʱƽ�ⳣ������ֵԼΪ5��10-82
C.�����£�NO��H2O��CO2���ֻ�����ֽ�ų�O2�������ɴ�С��˳��ΪNO>H2O>CO2
D.����˵��������ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ���COS������Ϊһ����ʳѬ�������ܷ�ֹijЩ���桢�߳�������Σ�����ں����ܱ������У���CO��H2S��ϼ��Ȳ��ﵽ����ƽ�⣺
CO��g��+H2S��g��![]() COS��g��+H2��g�� K=0.1
COS��g��+H2��g�� K=0.1
��ӦǰCO���ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol������˵����ȷ����
A. �����¶ȣ�H2SŨ�����ӣ������÷�Ӧ�����ȷ�Ӧ
B. ͨ��CO������Ӧ����������
C. ��ӦǰH2S���ʵ���Ϊ7mol
D. CO��ƽ��ת����Ϊ80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ù������ܽⲢ���ˣ�������ҺA��Ҫ��CO32-��Ni2����SO42-��H����Fe2����Fe3����OH����Mg2����Mn2���Ⱦ��������е����֡���A�н���Ԫ�ؽ��з����Ա����ã�����������ͼ��ʾ��
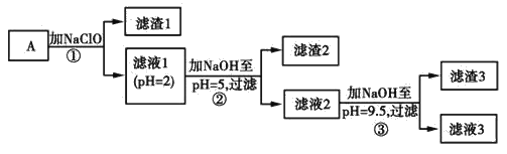
�����õ����й��������£�
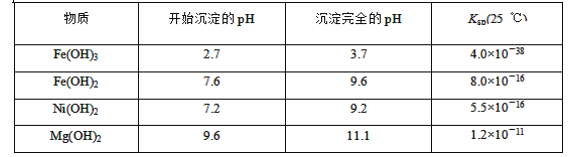
����������Ϣ��գ�
(1)��ҺA�в��ܴ������ڵ�����������________��
(2)��֪������1����MnO2������ٷ�����������ԭ��Ӧ�����ӷ���ʽΪ________��
(3)�����£�ijNi(OH)2��Mg(OH)2�������Ļ����ϵ�У���c(Ni2��)��5.5��10��11mol��L��1����c(Mg2��)��________��
(4)�ٶ��������NaClOǡ�÷�Ӧ����������Һ3�е�������ӣ������ȼ���________(�����ӷ���)��
(5)Ϊ�ⶨ�ÿ�������Ԫ�صĺ�����ȡ20.0 g��ʯ�����������̲�������________(��������1����������2����������3��)��ȫ���ܣ���ʹ���е���Ԫ�ػ�ԭΪFe2����Ȼ��������Һϡ�͵�100 mL��ȡ��20.00 mL��0.100 0 mol��L��1KMnO4��Һ�ζ����ﵽ�ζ��յ�ʱ��Һ��ɫΪ________ɫ��������KMnO4��Һ16. 00 mL���������������Ԫ�ص���������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������ȩ������������ͭ�ķ�Ӧʱ������NaOH�������Է�Ӧ������Ӱ�죬�������Dz��ÿ��Ʊ����ķ�������ʹ��0.5 mL 40%����ȩ��Һ��������ʵ�顣
��ȩ��Һ��������ʵ�飮
��� | 2%CuSO4��Һ����� | 10%NaOH��Һ����� | �� | pH | ����ȩˮԡ���Ⱥ�ij�����ɫ |
1 | 2mL | 3�� | dz����ɫ���� | 5��6 | dz����ɫ���� |
2 | a | 15�� | dz��ɫ���� | 7��8 | ��ɫ���� |
3 | 1mL | 1mL | ��ɫ���dz������� | 9��10 | ���ɫ���� |
4 | b | 2mL | ��ɫ���dz����϶� | 11��12 | ��ɫ���� |
5 | 1mL | 3mL | ����ɫ��Һ | 12��13 | ---- |
(1)�ϱ���a��bӦΪ������ĸ��ţ���___________________
A��15��1 mL B��2 mL��1 mL C��15��2 mL D��2 mL��2 mL
(2)�������Ͽ�֪��ʵ��1�е�dz����ɫ��������Ҫ�ɷ�ΪCu2(OH)2SO4�����Ȳ��ֽ⡣д������Cu
(3)С��ͬѧ�Ʋ�ʵ��3�еĺ��ɫ����������CuO��Cu2O�Ļ�����������___________��
(4)��ʵ��4���Եó����ۣ���NaOH�������ϴ�ʱ������������ͭ��������ȩ������Ӧ������Cu2O��ɫ�������÷�Ӧ�Ļ�ѧ����ʽΪ_________��
(5)Ϊ�˽�һ��֤��ʵ��4�к�ɫ�����ijɷ֣���С��ͬѧ�������ϵ�֪��Cu2O�ڼ����������ȶ�����������Һ�п�ת��ΪCu2+��Cu��������������ʵ�顣
������ʵ��4��Ӧ����Թܾ��ã��ý�ͷ�ι������ϲ���Һ��
�������²���Һ�м������ϡ���ᣬ��������ȣ�Ӧ�۲쵽��������_______________��
(6)С��ͬѧ�����������ϵ�֪��Cu(OH)2����OH-������Ӧ��������ɫ��Һ��[Cu(OH)4]2-�����ɴ�������⣺[Cu(OH)4]2-�ܷ�����ȩ������Ӧ�����ɺ�ɫ���������ʵ������һ���⣬������ʵ�鲽����__________________��������ʵ�飬��С��ͬѧ��ý��ۣ���ȩ���뷴Ӧ���ɺ�ɫ����ʱ���������ϵ��pH>10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����0.1 mol/L��NH4HCO3��Һ��pH =7.8����֪��������̼�������ķֲ�������ƽ��ʱij������Ũ��ռ������Ũ��֮�͵ķ�������pH�Ĺ�ϵ����ͼ��ʾ������˵������ȷ����

A. ������Kb(NH3��H2O)> Kal(H2CO3)
B. ��pH =6.5��������Һ����εμ�NaOH��Һʱ��NH4+��HCO3һŨ�ȶ���С
C. NH4HCO3��Һ�д��������غ��ϵ��c( NH4+) +c( NH3��H2O) =c(HCO3-)+c��CO3 2-��+c( H2 CO3)
D. ����Һ��pH =9ʱ����Һ�д������й�ϵ��c(HCO3-)>c(NH4+>c(NH3��H2O)>c��CO3 2-��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com