
【题目】短周期元素A、B、C的原子序数依次增大,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是( )
A.原子半径:A<B<C
B.三种元素的最高价氧化物对应水化物均可由化合反应得到
C.A的氢化物稳定性小于C的氢化物稳定性
D.B 和A的最高价氧化物可发生置换反应
【答案】D
【解析】
短周期元素A、B、C的原子序数依次增大,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则A原子核外有2个电子层,B有三个电子层,最外层有2个电子,B核外电子排布为2、8、2,B是Mg,它们的原子最外层电子数之和为10,则A核外电子排布是2、4,A是C,则C是Si。然后根据元素周期律分析解答。
根据上述分析可知A是C,B是Mg,C是Si元素。
A.同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径越大,所以原子半径:C<Si<Mg,A错误;
B.Si元素的最高价氧化物是SiO2,难溶于水,不能通过化合反应制取,B错误;
C.元素的非金属性越强,其相应的氢化物稳定性就越强。由于元素的非金属性C>Si,所以氢化物稳定性CH4>SiH4,C错误;
D.Mg在CO2中燃烧产生MgO和C,反应方程式为:2Mg+CO2![]() 2MgO+C,发生反应的基本类型是置换反应,D正确;
2MgO+C,发生反应的基本类型是置换反应,D正确;
故合理选项是D。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】某化合物的化学式为C5H11Cl,已知:分子中有两个—CH3、两个-CH2-、一个![]() 和一个-Cl,它的可能的结构有几种
和一个-Cl,它的可能的结构有几种
A. 2B. 3C. 4D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.治疗胃酸过多的药物达喜(其式量不超过 700)由五种短周期元素组成,按如下流程进行实验以确定其组成。
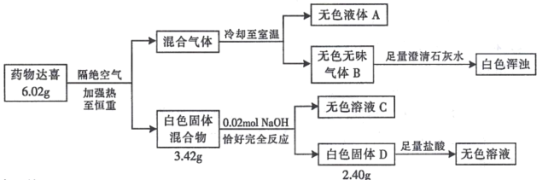
请回答:
(1)达喜的化学式是_____________。
(2)达喜与胃酸(含稀盐酸)反应的化学方程式是____________。
(3)气体 B 与环氧丙烷(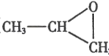 )可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
)可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
II.将 NaC1O3 溶液逐滴加入到碘单质和过量盐酸的混合液中可制备液态 ICl,实验装置如下图:
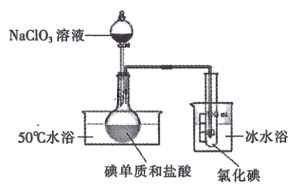
请回答:
(1)圆底烧瓶中发生的化学反应是______________( 用化学方程式表示)。
(2)若加入的 NaClO3 溶液已足量,请设计实验方案证明该反应已完全:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_____________
③根据上述反应可推知_______
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
c.还原性:AsH3>X d.还原性:X > AsH3
(2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在。其特征现象是_________________,若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为__________
②将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2SO4→Na2SO4+Bi2(SO4)3+NaMnO4+H2O,配平上述反应的化学方程式,并用双线桥标出电子转移的方向和数目__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是1mol金属镁和卤素反应的ΔH(单位:kJ·molˉ1)示意图,反应物和生成物均为常温时的稳定状态。下列选项中不正确的是
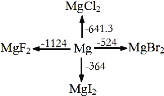
A.电解MgCl2制Mg是吸热反应
B.MgBr2与Cl2反应的ΔH<0
C.MgF2(s)+Br2(l) = MgBr2(s)+F2(g) ΔH=+600kJ·molˉ1
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
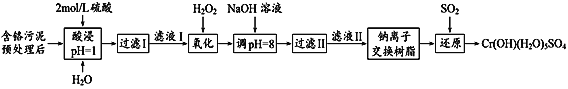
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。下列说法不正确的是
A.H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-
B.加入NaOH溶液使溶液呈碱性,可以将Cr2O72-转化为CrO42-
C.加入H2O2的离子方程式2Cr3++3H2O2+H2O=Cr2O72-+8H+
D.钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有Al3+、Ca2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
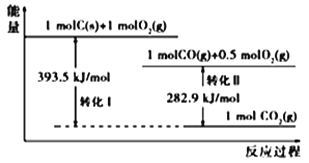
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= 221.2 kJmol1
D. CO的燃烧热ΔH=+282.9 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
完成下列填空:
(1)上述反应中的还原剂为___,还原产物有___,当有1molKNO3参加反应时,转移电子的数目为___。
(2)KNO3晶体类型是___,其晶体中存在的化学键有___。
(3)硫原子的核外电子排布式为___,原子核外有___种不同能量的电子。将SO2和Cl2分别通入品红溶液中,产生的现象是___;若将SO2和Cl2等体积混合后再缓缓通入品红溶液,发现品红溶液___,其原因是___。
(4)S、C和N三种元素的原子半径从小到大的顺序是___;K2S溶液中除OH-外其它各离子物质的量浓度的大小顺序为___。
(5)下列事实能说明碳与硫两元素非金属性相对强弱的有___。
a.同温同浓度溶液pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
d.分解温度:CH4>H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com