
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是

A.Ksp(Ag2CrO4)的数值为10-9.92
B.a点表示的是Ag2CrO4的不饱和溶液
C.沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好
D.Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO42-(aq)的平衡常数为1012.08
【答案】AC
【解析】
温度不变时,溶度积为常数,Ksp(AgSCN)= c(SCN-) c(Ag+),c(Ag+)增大,则c(SCN-)减小,二者浓度变化倍数相同;Ksp(Ag2CrO4)=c(CrO42-) c2(Ag+),c(Ag+)增大,则c(CrO42-)减小,但二者浓度的变化倍数不同,结合曲线分析,当c(Ag+)由10-6mol/L增大10-2mol/L,c(Xn-)由10-6mol/L减小到10-10mol/L,由此可知二者变化倍数相同,则可以断定下面的曲线为AgSCN溶解平衡曲线,上方的曲线为Ag2CrO4溶解平衡曲线,据此分析解答。
A.根据分析,上方的曲线为Ag2CrO4溶解平衡曲线,则Ksp(Ag2CrO4)= c(CrO42-) c2(Ag+)=10-3.92×(10-4)2=10-11.92,故A错误;
B.a点的c(Ag+)小于溶解平衡时的c(Ag+),则a点的浓度积Qc(Ag2CrO4)<Ksp(Ag2CrO4),为Ag2CrO4的不饱和溶液,故B正确;
C.溶度积越小,溶液中离子浓度越小,沉淀越完全,Ksp(Ag2CrO4)= c(CrO42-) c2(Ag+)=10-3.92×(10-4)2=10-11.92,Ksp(AgSCN)= c(SCN-) c(Ag+)=10-6×10-6=10-12,Ksp(AgSCN)<Ksp(Ag2CrO4),沉淀废液中的Ag+用KSCN溶液比等浓度的K2CrO4溶液效果好,故C错误;
D.Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO42-(aq)的平衡常数K= 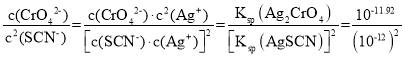 =1012.08,故D正确;
=1012.08,故D正确;
答案选AC。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y、W同主族,W的原子序数是Y的两倍,Z是地壳中含量最高的金属元素。下列说法正确的是( )
A.原子半径:r(Z)>r(W)>r(Y)>r(X)
B.由Y、W组成的化合物是共价化合物
C.Y的简单气态氢化物的热稳定性比W的弱
D.常温下Z的块状单质可溶于W最高价氧化物所对应的水化物的浓溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]()
![]() ,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高![]() 转化率的是( )
转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下已溶液显中性,它们转化关系如图所示,则下列说法中错误的是
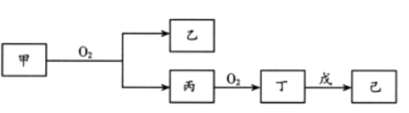
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.W的氢化物中的某一种具有漂白性
C.丙的电子式为![]()
D.W的氢化物沸点一定比Y的氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬(Cr)常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4(亚铬酸亚铁)制备Cr的流程如下(+6价铬元素在酸性条件下以Cr2O72-的形式存在)。下列说法错误的是
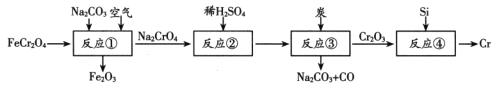
A.FeCr2O4中Cr元素的化合价为+3价
B.反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为3:1
C.反应③的化学方程式为Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
D.反应④中的Si可用Al来代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2===2Cl﹣+2Fe3+,2Br﹣+Cl2===Br2+2Cl﹣,2Fe2++Br2===2Br﹣+2Fe3+。含有amol FeBr2的溶液中,通入xmol Cl2,下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. x=0.4a,2Fe2++Cl2===2Fe3++2Cl﹣
B. x=0.6a,2Br﹣+Cl2===Br2+2Cl﹣
C. x=a,2Fe2++2Br﹣+2Cl2===Br2+2Fe3++4Cl﹣
D. x=1.5a,2Fe2++4Br﹣+3Cl2===2Br2+2Fe3++6Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
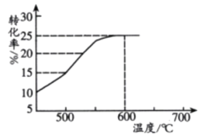
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,X是周期表中非金属最强的元素,W与X同主族,Y、Z是同周期相邻的两种元素,Z元素原子最外层电子数等于周期序数。下列说法正确的是
A.原子半径的大小顺序;![]()
B.简单氢化物的热稳定性:![]()
C.最高价氧化物对应水化物的碱性:![]()
D.工业上,常用电解含Y或Z简单离子溶液的方法冶炼单质Y或Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com