
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y、W同主族,W的原子序数是Y的两倍,Z是地壳中含量最高的金属元素。下列说法正确的是( )
A.原子半径:r(Z)>r(W)>r(Y)>r(X)
B.由Y、W组成的化合物是共价化合物
C.Y的简单气态氢化物的热稳定性比W的弱
D.常温下Z的块状单质可溶于W最高价氧化物所对应的水化物的浓溶液中
科目:高中化学 来源: 题型:
【题目】为解决大气中CO2的含量增大的问题,某科学家提出把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,再转变为燃料甲醇的“绿色自由”构想,其部分技术流程如图:
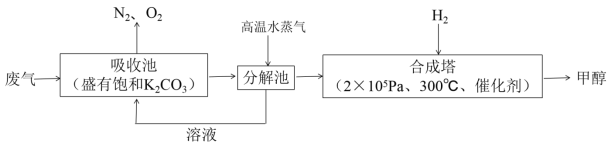
(1) 吸收池中主要反应的离子方程式为____
(2) 合成塔中合成1molCH3OH(g)的反应热是ΔH1,则该反应的热化学方程式为____;工业上CO也可用于合成甲醇,已知:2CO(g)+O2(g)=2CO2(g) ΔH2;2H2(g)+O2(g)=2H2O(g) ΔH3;则CO(g)+2H2(g)=CH3OH(g) ΔH4=____(用ΔH1、ΔH2、ΔH3表示)。
(3) 一定温度下,向2L恒容密闭容器中加入1molCH3OH(g),发生反应CH3OH(g)![]() CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
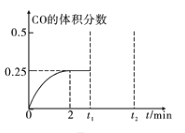
① 反应达到平衡状态的标志是____(填序号)。
A. 气体的密度保持不变
B. 气体的平均摩尔质量保持不变
C . 2v正(H2)=v逆(CO)
D. c(CH3OH):c(CO):c(H2)=1:1:2的时候
E. 气体的体积分数保持不变
② 在该温度下,此反应的化学平衡常数K=______,若在t1时刻再加入1mol CH3OH(g),在t2时刻重新达到平衡,则在t2时刻CO的体积分数____0.25(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g),在427 ℃时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/ L,计算一氧化碳在此反应条件下的转化率_____________。
CO2(g)+H2(g),在427 ℃时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/ L,计算一氧化碳在此反应条件下的转化率_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )

A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代有火烧孔雀石炼铜(加入炭)和湿法炼铜(在溶液中加铁),下列有关说法不正确的是( )
A. 火烧孔雀石炼铜发生的反应有Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
B. 火烧孔雀石炼铜发生的反应有2CuO+C![]() CO2↑+2Cu
CO2↑+2Cu
C. 湿法炼铜发生的主要反应为Fe+Cu2+===Cu+Fe2+
D. 两种炼铜的方法涉及的主要反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有0.5molL-1盐酸、0.55molL-1NaOH溶液及如图的仪器,尚缺少的实验玻璃用品是____。

(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?____(填“能”或“否”),其原因是 ____。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热△H(平均值) | ||
t1 | t2 | |||
① | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.3℃ | ____ |
② | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ℃-1Kg-1,各物质的密度均为1gcm-3。完成表格。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质是电解质的有___,是非电解质的有___,在本题指定状态下能导电的有___。(以上各空均填序号)
①CO2、②液态HCl、③稀硝酸、④Al2(SO4)3晶体、⑤NH3、⑥熔融KOH、⑦单质铁
(2)胶体是一种常见的分散系,向煮沸的蒸馏水中逐滴加入___溶液,继续煮沸至___,停止加热,可制得Fe(OH)3胶体。制取Fe(OH)3胶体化学反应方程式为___。区分胶体和溶液常用的方法叫做___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是

A.Ksp(Ag2CrO4)的数值为10-9.92
B.a点表示的是Ag2CrO4的不饱和溶液
C.沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好
D.Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO42-(aq)的平衡常数为1012.08
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com