
【题目】(1)下列物质是电解质的有___,是非电解质的有___,在本题指定状态下能导电的有___。(以上各空均填序号)
①CO2、②液态HCl、③稀硝酸、④Al2(SO4)3晶体、⑤NH3、⑥熔融KOH、⑦单质铁
(2)胶体是一种常见的分散系,向煮沸的蒸馏水中逐滴加入___溶液,继续煮沸至___,停止加热,可制得Fe(OH)3胶体。制取Fe(OH)3胶体化学反应方程式为___。区分胶体和溶液常用的方法叫做___。
【答案】②④⑥ ①⑤ ③⑥⑦ 饱和FeCl3溶液 溶液呈红褐色 FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl 丁达尔效应
Fe(OH)3(胶体)+3HCl 丁达尔效应
【解析】
(1)电解质是指在水溶液中或熔化状态下能够导电的化合物,包括酸、碱、盐、水和活泼金属氧化物;非电解质是指在水溶液中或熔化状态下能够导电的化合物。能导电的物质包括金属单质及合金、石墨;酸、碱、盐的水溶液、熔融的强碱和部分盐。据此作答;
(2)根据胶体的性质进行分析。
(1)②液态HCl、④Al2(SO4)3晶体、⑥熔融KOH都属于化合物,在水溶液中或熔融状态下能够导电,所以电解质;
故答案为:②④⑥;
①CO2、⑤NH3是化合物,在水溶液中和熔融状态下都不能由于自身电离而导电,属于非电解质;
故答案为:①⑤;
③稀硝酸、⑥熔融KOH存在自由移动的离子,能够导电,⑦单质铁存在自由电子,能够导电,故答案为:③⑥⑦;
(2)胶体是一种分散质粒子直径在1~100nm之间的一种分散系,配制氢氧化铁胶体就是将饱和的氯化铁溶液加入沸水中,继续加热,直到溶液变成红褐色,停止加热,可制得Fe(OH)3胶体;制取Fe(OH)3胶体化学反应方程式为FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl;区分胶体和溶液常用的方法叫做丁达尔效应。
Fe(OH)3(胶体)+3HCl;区分胶体和溶液常用的方法叫做丁达尔效应。


科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y、W同主族,W的原子序数是Y的两倍,Z是地壳中含量最高的金属元素。下列说法正确的是( )
A.原子半径:r(Z)>r(W)>r(Y)>r(X)
B.由Y、W组成的化合物是共价化合物
C.Y的简单气态氢化物的热稳定性比W的弱
D.常温下Z的块状单质可溶于W最高价氧化物所对应的水化物的浓溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 [实验化学]
3,4亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4亚甲二氧基苯甲醛制备,其反应方程式为

实验步骤如下:
步骤1:向反应瓶中加入3,4亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4亚甲二氧基苯甲酸固体。
(1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,![]() 转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
(2)步骤2中,趁热过滤除去的物质是__________________(填化学式)。
(3)步骤3中,处理合并后溶液的实验操作为__________________。
(4)步骤4中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得甲、乙两烧杯中生成的气体体积之比为2:3,则加入的铝粉质量可能为( )
A.8.1gB.3.6gC.5.4gD.4.05g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等物质的量的氧气(O2)和臭氧(O3),所含的分子数之比为___,所含的氧原子数之比为___,其相对分子量之比为___,其质量之比为___;若O2和 O3质量相等,则其分子数之比为___,氧原子数之比___。
(2)一定条件下,硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2↑+9H2O,用双线桥标出电子转移情况___。5NH4NO3═2HNO3+4N2↑+9H2O,在该反应中是氧化产物___,被氧化与被还原的N原子个数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]()
![]() ,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高![]() 转化率的是( )
转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下已溶液显中性,它们转化关系如图所示,则下列说法中错误的是
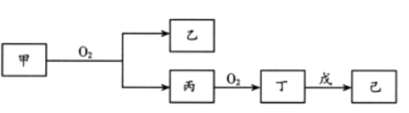
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.W的氢化物中的某一种具有漂白性
C.丙的电子式为![]()
D.W的氢化物沸点一定比Y的氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,X是周期表中非金属最强的元素,W与X同主族,Y、Z是同周期相邻的两种元素,Z元素原子最外层电子数等于周期序数。下列说法正确的是
A.原子半径的大小顺序;![]()
B.简单氢化物的热稳定性:![]()
C.最高价氧化物对应水化物的碱性:![]()
D.工业上,常用电解含Y或Z简单离子溶液的方法冶炼单质Y或Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com