
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得甲、乙两烧杯中生成的气体体积之比为2:3,则加入的铝粉质量可能为( )
A.8.1gB.3.6gC.5.4gD.4.05g
【答案】A
【解析】
硫酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,又两烧杯中分别加入等质最的铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6H+═2Al3++3H2↑
6 3
0.6mol x
![]() =
=![]() ,解得x=0.3mol,
,解得x=0.3mol,
一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.3mol×![]() =0.45mol,
=0.45mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.45mol
![]() =
=![]() ,解得y=0.3mol,
,解得y=0.3mol,
则铝的质量为0.3mol×27g/mol=8.1g,
答案选A。


科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
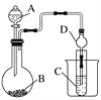
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有0.5molL-1盐酸、0.55molL-1NaOH溶液及如图的仪器,尚缺少的实验玻璃用品是____。

(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?____(填“能”或“否”),其原因是 ____。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热△H(平均值) | ||
t1 | t2 | |||
① | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.3℃ | ____ |
② | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ℃-1Kg-1,各物质的密度均为1gcm-3。完成表格。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质是电解质的有___,是非电解质的有___,在本题指定状态下能导电的有___。(以上各空均填序号)
①CO2、②液态HCl、③稀硝酸、④Al2(SO4)3晶体、⑤NH3、⑥熔融KOH、⑦单质铁
(2)胶体是一种常见的分散系,向煮沸的蒸馏水中逐滴加入___溶液,继续煮沸至___,停止加热,可制得Fe(OH)3胶体。制取Fe(OH)3胶体化学反应方程式为___。区分胶体和溶液常用的方法叫做___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质转化的化学方程式。

①_____________________________________________,
②_____________________________________________,
③_____________________________________________,
(2)写出下列物质转化的化学方程式。

①_____________________________________________,
②_____________________________________________,
③_____________________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列叙述错误的是
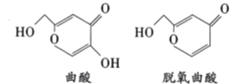
A.两物质都能使溴的四氯化碳溶液褪色
B.曲酸经消去反应可得脱氧曲酸
C.1mol脱氧曲酸最多能与3molH2发生加成反应
D.曲酸与脱氧曲酸中含有相同种类的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
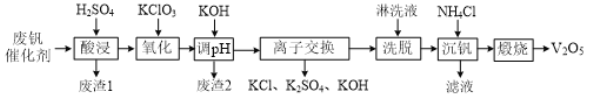
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com