
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列叙述错误的是
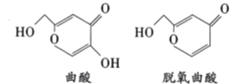
A.两物质都能使溴的四氯化碳溶液褪色
B.曲酸经消去反应可得脱氧曲酸
C.1mol脱氧曲酸最多能与3molH2发生加成反应
D.曲酸与脱氧曲酸中含有相同种类的官能团
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得甲、乙两烧杯中生成的气体体积之比为2:3,则加入的铝粉质量可能为( )
A.8.1gB.3.6gC.5.4gD.4.05g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]()
![]() ,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高![]() 转化率的是( )
转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
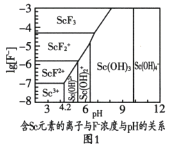
【题目】“稀土之父”徐光宪对稀土萃取分离做出了巨大贡献。稀土是隐形战机、超导、核工业等高精尖领域必备的原料。钪(Sc)是稀土金属之一,如图是制备Sc的工艺流程。

已知:xNH4ClyScF3zH2O是ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。“脱水除铵”是复盐沉淀的热分解过程。
据此回答:
(1)在空气中焙烧Sc2(C2O4)3只生成一种碳氧化物的化学方程式为 ________。
(2)图1是含Sc元素的离子与F-浓度和pH的关系。用氨调节溶液pH,调节3.5<pH<4.2原因是________。
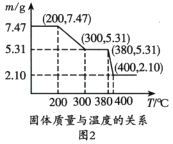
(3)图2是“脱水除铵”过程中固体质量与温度的关系,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3,由图像中数据计算复盐中x:z=________;工艺流程中可回收利用的物质是________。
(4)传统制备ScF3的方法是先得到ScF36H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是________(用化学方程式表示)。流程中将复盐沉淀后“脱水除铵”制得纯度很高的SeF3,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下已溶液显中性,它们转化关系如图所示,则下列说法中错误的是
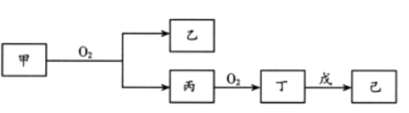
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.W的氢化物中的某一种具有漂白性
C.丙的电子式为![]()
D.W的氢化物沸点一定比Y的氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬(Cr)常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4(亚铬酸亚铁)制备Cr的流程如下(+6价铬元素在酸性条件下以Cr2O72-的形式存在)。下列说法错误的是
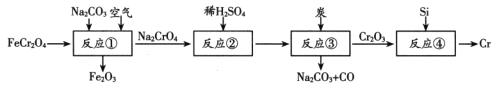
A.FeCr2O4中Cr元素的化合价为+3价
B.反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为3:1
C.反应③的化学方程式为Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
D.反应④中的Si可用Al来代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
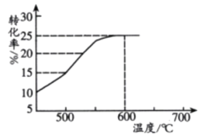
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,B的转化率提高
A.①②B.②④C.①③D.②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com