
【题目】(1)写出下列物质转化的化学方程式。

①_____________________________________________,
②_____________________________________________,
③_____________________________________________,
(2)写出下列物质转化的化学方程式。

①_____________________________________________,
②_____________________________________________,
③_____________________________________________,
【答案】2Na + O2![]() Na2O2 2Na2O2 + 2CO2 == 2Na2CO3 + O2 Na2CO3 + 2HCI =2NaCI + H2O + CO2 2Al + 6HCl = 2AlCl3 + H2 AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl Al(OH)3 + NaOH = NaAlO2 + 2H2O
Na2O2 2Na2O2 + 2CO2 == 2Na2CO3 + O2 Na2CO3 + 2HCI =2NaCI + H2O + CO2 2Al + 6HCl = 2AlCl3 + H2 AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl Al(OH)3 + NaOH = NaAlO2 + 2H2O
【解析】
(1)①钠在氧气中燃烧生成过氧化钠,故答案为:2Na + O2  Na2O2;
Na2O2;
②过氧化钠和二氧化碳反应生成碳酸钠和氧气,故答案为:2Na2O2 + 2CO2 =2Na2CO3 + O2;
③碳酸钠和盐酸反应生成氯化钠,故答案为:Na2CO3+2HCl=2NaCl+ H2O+CO2;
(2)①铝单质和盐酸反应可以生产氯化铝,故答案为:2Al + 6HCl = 2AlCl3 + H2;
②氯化铝与氨水反应生成氢氧化铝沉淀,故答案为:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl;
③氢氧化铝与氢氧化钠反应生成偏铝酸钠,故答案为:Al(OH)3 + NaOH = NaAlO2 + 2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
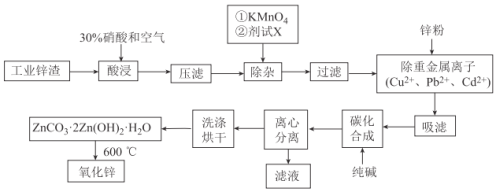
已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 将 | 生成了 |
B | 向浓度均为 |
|
C | 淀粉 | 还原性: |
D | 用pH试纸测得: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得甲、乙两烧杯中生成的气体体积之比为2:3,则加入的铝粉质量可能为( )
A.8.1gB.3.6gC.5.4gD.4.05g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol·L-1A气体和1mol·L-1B气体混合,并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质B表示的反应的平均速率为0.6mol·L-1·s-1
②用物质A表示的反应的平均速率为0.3mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A.① ③B.③ ④C.② ③D.② ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]()
![]() ,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高![]() 转化率的是( )
转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土之父”徐光宪对稀土萃取分离做出了巨大贡献。稀土是隐形战机、超导、核工业等高精尖领域必备的原料。钪(Sc)是稀土金属之一,如图是制备Sc的工艺流程。

已知:xNH4ClyScF3zH2O是ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。“脱水除铵”是复盐沉淀的热分解过程。
据此回答:
(1)在空气中焙烧Sc2(C2O4)3只生成一种碳氧化物的化学方程式为 ________。
(2)图1是含Sc元素的离子与F-浓度和pH的关系。用氨调节溶液pH,调节3.5<pH<4.2原因是________。
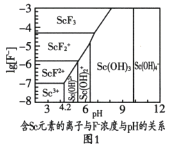
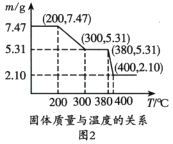
(3)图2是“脱水除铵”过程中固体质量与温度的关系,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3,由图像中数据计算复盐中x:z=________;工艺流程中可回收利用的物质是________。
(4)传统制备ScF3的方法是先得到ScF36H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是________(用化学方程式表示)。流程中将复盐沉淀后“脱水除铵”制得纯度很高的SeF3,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬(Cr)常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4(亚铬酸亚铁)制备Cr的流程如下(+6价铬元素在酸性条件下以Cr2O72-的形式存在)。下列说法错误的是
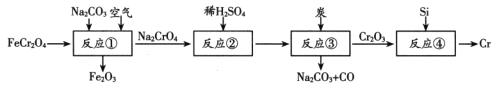
A.FeCr2O4中Cr元素的化合价为+3价
B.反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为3:1
C.反应③的化学方程式为Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
D.反应④中的Si可用Al来代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Na2O、CaO、CuO、Fe2O3和SiO2中的若干种,为确定其成分,现取X进行如下实验(所加试剂均过量),下列说法正确的是
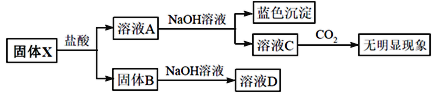
A.该混合物一定含有CuO、SiO2B.该混合物可能含有Na2O和Fe2O3
C.该混合物一定不含CaO和Na2OD.无法确定是否含有CaO和Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com