
【题目】若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是
A. 该元素原子最外层共有3个电子
B. 该元素位于第5周期ⅡA族
C. 该元素原子核外第N层上共有9个不同状态的电子
D. 该元素原子第四电子层上有5个空轨道
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对平衡体系H2(g)+I2(g)![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
B. 用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少
C. 实验室可用排饱和食盐水的方法收集氯气
D. 工业合成三氧化硫的过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
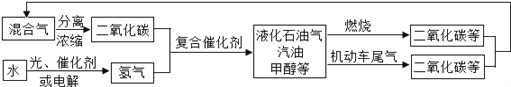
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是不变的;②燃烧时化学能可以转化为热能和光能;
③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;
⑤二氧化碳可成为一种重要的资源。
A. ①②③④ B. ①②③⑤ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种橙红色固体,可用于火柴制造、电镀、有机合成等方面。用某酸性废液(主要含Cr3+、还含有少量Fe2+、Fe3+和Al3+等)制备的流程如下:

已知:H++CrO2-+H2O![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH-
Cr3++3OH-
回答下列问题:
(1)沉淀A的主要成分是_____________(填化学式,下同),流程中的X是__________。
(2)滤液Ⅰ中铬元素的存在形式主要是_____________(填离子符号)。
(3)操作是向滤液中加入稀硫酸调PH至一定范围。在酸性环境中CrO42-转化为Cr2O72-,溶液变为橙红色,该转化的离子方程式是__________;若PH高于此范围,造成的影响是__________。
(4)操作②是向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,说明相同温度下,在水中的溶解度:Na2Cr2O7______________ K2Cr2O7(填“>”、“<”或“=”)。
(5)PbO2可直接将溶液中的Cr3+氧化成Cr2O72-,该反应的离子方程式是__________。
(6)K2Cr2O7可用来测定溶液中Fe2+的含量,还原产物为Cr3+。若1L FeSO4溶液与100mL 0.1mol/L K2Cr2O7溶液恰好完全反应,则c(FeSO4)=___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B.淀粉和纤维素都可以作为工业上生产葡萄糖的原料
C.油脂的水解反应,都是皂化反应
D.蔗糖是高分子化合物,其水解产物能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是__________(填序号)
A.氢 B.碳 C.氧 D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有铝元素?___________。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为:________________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为 _____________________________。
信息⑤:X与W同主族
(5)①X与浓硫酸加热时反应的化学方程式为______________________。
②工业上通过X与W的化合物制W的单质的化学方程式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5molL﹣1的盐酸10mL稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为( )
A.0.5 molL﹣1
B.0.25 molL﹣1
C.0.1 molL﹣1
D.1 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g) 反应的平衡常数和温度的关系如下:
C(g)+D(g) 反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
完成下列填空:
(1)该反应的平衡常数表达式K=______,该反应为_____反应(选填“ 吸热”、“放热”)。当反应达到平衡时,升高温度,A的转化率_____(选填“增大”、“减小”或“不变”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol/(L·s),则6s时c(A)=______mol/L,C的物质的量为____mol.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molA(g)和3molB(g),判断该反应达到平衡状态的依据是___________。
a.c(A)=c(C) b.容器中压强不变
c.混合气体的平均相对分子质量不变 d.v逆(D)=v正(B)
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com