
【题目】下列关于反应与能量的说法正确的是
A.Zn(s)+CuSO4(aq)![]() ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
B.CaCO3(s)![]() CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
C.HCl(g)![]()
![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
D.H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
【答案】B
【解析】
A. 反应物的总能量大于生成物的总能量的反应为放热反应;
B. 反应物的总能量小于生成物的总能量的反应为吸热反应
C. 该反应为吸热反应;
D. 强酸强碱的稀溶液发生中和反应生成1mol水时放出的热量为中和热。
A. 该反应为放热反应,反应物的总能量大于生成物的总能量,即E反应物>E生成物,A项错误;
B. 该反应为吸热反应,反应物的总能量小于生成物的总能量,即E反应物<E生成物,B项正确;
C. 该反应为吸热反应,因此1 mol HCl在密闭容器中分解后吸收92.3 kJ的热量,C项错误;
D. 浓硫酸反应时放出更多的热量,因此含1 mol NaOH的烧碱溶液与0.5 mol H2SO4的浓H2SO4混合后放出的热量大于57.3 kJ,D项错误;
答案选B。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O![]() H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O![]() H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
⑥HS-的水解:HS-+H2O![]() S2-+H3O+
S2-+H3O+
⑦将饱和FeCl3溶液滴入沸腾的水中:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
A.①②③④B.①②③
C.②③⑤⑥⑦D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )
2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )

A.反应物的总能量低于生成物的总能量
B.断开1molH—H键和1molI—I键所需能量大于断开2 molH—I键所需能量
C.断开2mol H—I键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量等于2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
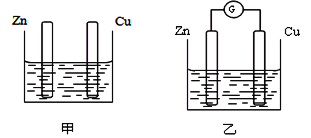
(1)以下叙述中,正确的是________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为________;乙为____________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______________________ 。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应式__________________。当电路中转移0.2 mol电子时,消耗负极材料的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆及其化合物作为新材料,具有相当重要的意义。氧氯化锆(ZrOCl2)是制备锆系列材料的一种重要中间产品,用锆英砂(主要成分ZrSiO4)制备水合氧氯化锆有多种方法,目前使用较多的是“一酸一碱法”,其主要流程如图:
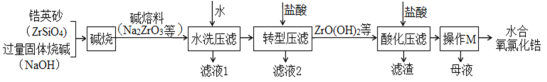
已知:①Na2ZrO3在强碱性的介质中不溶解或水解;②硅酸和原硅酸都具有吸附性。
回答下列问题:
(1)“碱烧”过程中生成“碱熔料”的化学方程式为___。
(2)“水洗压滤”工艺可以将30~70%的硅除去,如图表示的是各种工艺变化对水洗除硅率的影响,则为了提高除硅率应采取的措施是___(任意回答两条即可)。
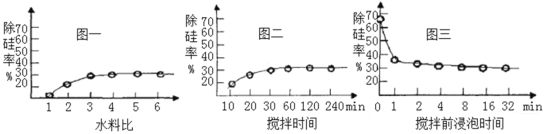
(3)硅的去除还有一部分是通过上述流程中的___工艺实现的,这一部分硅转化成的物质是___(填化学式)。
(4)水洗压滤的主要目的是除硅,则转型压滤的主要目的是除去___,转型压滤过程中生成ZrO(OH)2的离子方程式为___。
(5)操作M包括___、过滤、洗涤、干燥;上述工艺若不加改进,锆的损失会比较大,为了减少锆的损失,应该改进的措施是___。
(6)称取3.220g产品(水合氧氯化锆),溶于盐酸配制成1000mL溶液,取25mL于锥形瓶中,加热至90℃以上,并滴入2滴二甲酚橙指示剂,趁热用0.0125molL-1EDTA标准溶液滴定,当溶液由红色变为黄色且半分钟不褪色时,消耗EDTA溶液20mL。计算水合氧氯化锆的化学式为___(EDTA与ZrO2+在上述条件下以1:1比例反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扎来普隆是一种短期治疗失眠症的药物,其合成路线如下:

回答下列问题:
(1)A中的官能团名称是________________。
(2)![]() 所需的试剂和条件分别为________________。
所需的试剂和条件分别为________________。
(3)![]() 、
、![]() 的反应类型依次为________、________。
的反应类型依次为________、________。
(4)扎来普隆的分子式为________________。
(5)![]() 的化学方程式为________________________。
的化学方程式为________________________。
(6)属于芳香化合物,且含有硝基,并能发生银镜反应的B的同分异构体有________种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式有________________。
(7)已知:![]() 有碱性且易被氧化。设计由
有碱性且易被氧化。设计由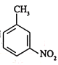 和乙醇制备
和乙醇制备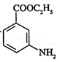 的合成路线(无机试剂任选)。________
的合成路线(无机试剂任选)。________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com