
| A、常用危险化学品包括:强氧化剂、压缩气体、液化气体、放射性物质等 |
| B、以mol为单位,可以计量分子、原子、质子、电子、胶体粒子等微观粒子 |
| C、物质体积的大小,取决于组成物质粒子的大小和粒子间的距离 |
| D、制备蒸馏水时,当一出现馏出液时应立即收集 |


科目:高中化学 来源: 题型:
| 时间(Min) 浓度(mol?L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2+3H2?2NH3 |
| B、H2 (g)+I2 (g)?2HI(g) |
| C、2NO2?N2O4 |
| D、HCl+NaOH?NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HBr |
| B、HCl |
| C、H2 |
| D、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
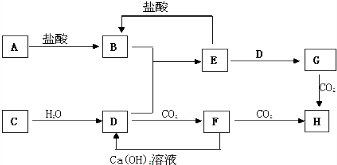
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | X | Y | Z | W | 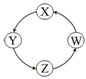 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A、①②③ | B、①③④ |
| C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁在空气中燃烧可生成氧化铁,镁在空气中燃烧可生成氧化镁、氮化镁 |
| B、分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 |
| C、红宝石、蓝宝石的主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐 |
| D、针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-o |
| 键能(Kj/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com