
| 3 |
| 4 |
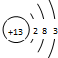 ,故答案为:
,故答案为: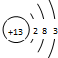 ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| A、常用危险化学品包括:强氧化剂、压缩气体、液化气体、放射性物质等 |
| B、以mol为单位,可以计量分子、原子、质子、电子、胶体粒子等微观粒子 |
| C、物质体积的大小,取决于组成物质粒子的大小和粒子间的距离 |
| D、制备蒸馏水时,当一出现馏出液时应立即收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯乙烯可通过加聚反应生成高分子化合物 |
| B、CaC2,MgCl2,Na2O2中都含有共价键 |
| C、由水电离出的e(H+)=1.0*10-5mol?L-1的溶液中,可能含有Fe3+,NH4+,MnO4-,SO42- |
| D、若只已知某物质的实验式为C2H5,仍确定其化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的一种单质是自然界硬度最大的晶体 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+1 |
| Z | Z的基态原子L层电子数是K层电子数的3倍 |
| W | W的一种核素的质量数为58,中子数为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,两容器中反应物的转化率不同 |
| B、达到平衡时,甲中NH3的体积分数与乙相等 |
| C、达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
| D、乙中的热化学反应方程式为2NH3(g)?N2(g)+3H2(g);△H=+Q2KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、低温 |
| B、高温 |
| C、任何温度下都能自发进行 |
| D、任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
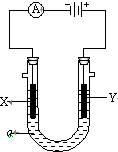 如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO和N2互为等电子体,常温常压下,22.4L的CO与1monN2所含的电子数相等 |
| B、7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1N |
| C、1.0L0.1mol/L的醋酸溶液中含CH3COOH、CH3COO-粒子总数为0.1NA |
| D、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com