
| A、达到平衡时,两容器中反应物的转化率不同 |
| B、达到平衡时,甲中NH3的体积分数与乙相等 |
| C、达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
| D、乙中的热化学反应方程式为2NH3(g)?N2(g)+3H2(g);△H=+Q2KJ/mol |
| 2-2x |
| 2 |
| 0.8 |
| 1 |
| 2-2x |
| 2 |


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
| 序号 | X | Y | Z | W | 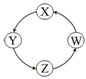 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A、①②③ | B、①③④ |
| C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的颜色变浅 |
| B、混合气体的物质的量相等 |
| C、混合气中NO2、NO、O2物质的量之比为2:2:1 |
| D、单位时间内生成2nmolNO同时生成2nmolNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ |
| B、稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ |
| C、盐酸滴在石灰石上:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、把金属钠放入水中:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用惰性电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| B、向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2 | ||||
| D、C12通入澄清石灰水中:C12+2OH-=C1-+CIO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com